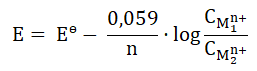Obliczanie stopnia przereagowania nadmiarowego substratu reakcji karbidu z wodą. Temat I - stopień przereagowania
Stopień przereagowania substratu w danej reakcji chemicznej jest to stosunek jego ilości jaka weszła w reakcję do ilości początkowej. Jeśli substraty zmieszane zostały w stosunku stechiometrycznym, wówczas wielkość ta równa jest co do wartości wydajności reakcji chemicznej. Karbid reaguje z wodą zgodnie z równaniem:
CaC2 + 2H2O → Ca(OH)2 + C2H2
W kolbie odważono 16 g pokruszonego karbidu, następnie ostrożnie, małymi porcjami wprowadzono jeszcze 12 cm3 wody destylowanej. Powstały acetylen zebrano i zmierzono jego objętość, która w temperaturze 25 oC pod ciśnieniem normalnym wynosiła 5,96 dm3.
Oblicz procentowy stopień przereagowania nadmiarowego substratu. Wynik podaj z dokładnością do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji dysocjacji kwasu ortofosforowego(V) oraz wybór anionu o najwyższym i najniższym stężeniu molowym
Wartość pH roztworów słabych, wieloprotonowych kwasów zależy praktycznie wyłącznie od stężenia jonów wodorowych powstałych w pierwszym etapie dysocjacji kwasu. Przykładem takiego związku chemicznego jest kwas ortofosforowy(V), którego wartość stałej równowagi dysocjacji elektrolitycznej (25 ⁰C) w pierwszym etapie wynosi 7,1∙10–3, a w kolejnych równa jest odpowiednio 6,3∙10–8 oraz 4,4∙10–13.
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz, stosując teorię Brønsteda-Lowry’ego równania procesu dysocjacji elektrolitycznej kwasu ortofosforowego(V). Następnie określ wzór sumaryczny tego jonu zawierającego atom fosforu, którego stężenie molowe jest najwyższe oraz tego o najniższym stężeniu molowym w wodnym roztworze kwasu ortofosforowego(V). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie całkowitej wydajności procesu wieloetapowego. Temat I - wydajność reakcji, proces wieloetapowy
Pewien związek chemiczny X uzyskuje się w trójetapowym procesie chemicznym:
Etap 1: A + B → 2C + D
Etap 2: C + E → F
Etap 3: 3F + 2Y → 2X + G
Oblicz całkowitą wydajność procesu prowadzącego do utworzenia związku chemicznego X, jeśli wydajności poszczególnych etapów reakcyjnych wynoszą kolejno: 70%, 90% oraz 65%. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości pierwiastka uzyskanego w wieloetapowym procesie reakcyjnym. Temat I - wydajność reakcji, proces wieloetapowy
Tak zwany antymon metaliczny otrzymuje się w dwuetapowym procesie reakcyjnym, z wyjściowego surowca, jakim jest siarczek antymonu(III) – antymonit:
Sb2S3 + 5O2 → Sb2O4 + 3SO2 (etap I)
Sb2O4 + 4C → 2Sb + 4CO (etap II)
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Uzasadnij obliczeniami, czy przy wydajności równej 90% każdego etapu reakcyjnego, możliwe jest uzyskanie 210 g antymonu, jeśli dysponujemy 400 g rudy o zawartości 85% antymonitu? Wynik zaokrąglij do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie niezbędnej ilości substratu użytego w wieloetapowym procesie. Temat I - wydajność reakcji, proces wieloetapowy
Podczas reakcji kwasu siarkowego(VI) z chloranem(V) potasu powstaje nietrwały kwas chlorowy(V), który rozkłada się zgodnie z równaniem:
3HClO3 → 2ClO2 + HClO4 + H2O
Z uwagi na wybuchowy charakter rozkładu tlenku chloru(IV) w temperaturze bliskiej 333 K, konieczne jest zapewnienie stałej temperatury (273 K) układu reakcyjnego:
2ClO2 → Cl2 + 2O2
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, jaką masę chloranu(V) potasu należy odważyć, aby przy wydajności każdego z etapów reakcyjnych równej 90%, otrzymać 14 dm3 chloru odmierzonego w warunkach normalnych? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, czy powstanie wystarczająca ilość azotu przeznaczonego do reakcji syntezy amoniaku. Temat I - wydajność reakcji
Na skalę laboratoryjną tlenek chromu(III) otrzymuje się podczas termicznego rozkładu dwuchromianu(VI) amonu:
(NH4)2Cr2O7 ⟶ Cr2O3 + N2 + 4H2O
Przez 10 sekund w tyglu porcelanowym prażono 12,6 g dwuchromianu(VI) amonu. Po tym czasie reakcję wstrzymano przez gwałtowne schłodzenie zawartości naczynia, a następnie ostrożnie odparowano powstałą wodę. Masa stałej pozostałości wynosiła 9,27 g.
Wykonując stosowne obliczenia określ, czy ilość azotu wydzielona w wyniku całkowitego rozkładu 12,6 g dwuchromianu(VI) amonu będzie wystarczająca, aby w reakcji z wodorem możliwe było uzyskanie z 75% wydajnością 1 dm3 amoniaku (w przeliczeniu na warunki normalne)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej objętości wody użytej w reakcji z azotkiem magnezu. Temat I - wydajność reakcji, proces wieloetapowy
Na pewną ilość azotku magnezu (Mg3N2) podziałano w nadmiarze wodą z dodatkiem kilku kropli fenoloftaleiny. W opisanych warunkach prowadzonego doświadczenia oprócz wodorotlenku magnezu powstał również bezbarwny gaz o charakterystycznej, drażniącej woni, który zbierano w baloniku (rysunek obok). Po zakończeniu reakcji balonik zamknięto, wypuszczono i zaobserwowano jego unoszenie się do góry. Pozostałą w kolbie mieszaninę wyprażono do stałej masy i uzyskano 10 g białej substancji, w której jony magnezowe stanowiły 60% (procenty wagowe).
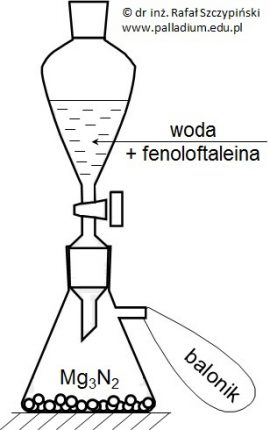
Załóżmy, że wydajność pierwszego etapu reakcyjnego wyniosła 100%, natomiast w drugim etapie reakcja biegła z 95% wydajnością.
Oblicz, jakiej minimalnej objętości wody (warunki normalne) należałoby użyć, w celu całkowitego przereagowania azotku magnezu? Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Procentowa wydajność reakcji syntezy tlenku siarki(VI) obliczona na podstawie składu ilościowego mieszaniny reagentów. Temat I - wydajność reakcji
Ułamkiem molowym składnika mieszaniny nazywa się stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny. W wyniku prowadzonej w obecności katalizatora reakcji tlenu z tlenkiem siarki(IV) powstaje tlenek siarki(VI). Przygotowano 51,2 g mieszaniny substratów, w której procent wagowy tego o mniejszej masie cząsteczkowej wynosił 25%.
Oblicz procentową wydajność opisanej przemiany, jeśli ułamek molowy produktu w poreakcyjnej mieszaninie reagentów równy był 0,2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru hydratu chlorku żelaza(III) na podstawie kilku reakcji następczych. Temat I - wydajność reakcji, proces wieloetapowy
W celu ustalenia wzoru hydratu chlorku żelaza(III) na wodny roztwór powstały w wyniku rozpuszczenia 4,51 g tego hydratu podziałano nadmiarową ilością roztworu wodorotlenku sodu. Osad przemyto, wyprażono i zważono. Masa uzyskanego w ten sposób tlenku żelaza(III) wynosiła 1,06 g.
Określ wzór hydratu, jeśli całkowita wydajność procesu prowadzącego do otrzymania tlenku wyniosła 80%. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis sumarycznego równania reakcji przebiegającej w ogniwie chemicznym zbudowanym z półogniw redoks
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz sumaryczne równanie reakcji chemicznej przebiegającej podczas pracy tego ogniwa oraz oblicz jego SEM w stanie standardowym. Równanie reakcji: SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór jonu będącego najsilniejszym utleniaczem oraz zapis barwy roztworu
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Spośród jonów potencjałotwórczych znajdujących się w opisanym ogniwie chemicznym wybierz i napisz wzór sumaryczny tego, który jest najsilniejszym utleniaczem. Określ barwę roztworu związku chemicznego zawierającego wybrany przez Ciebie jon, jeśli w układzie nie będzie obecna żadna inna drobina nadająca zabarwienie. Wzór jonu: Barwa roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie potencjału redoks półogniwa dla różnych stężeń molowych jonów potencjałotwórczych
Wartość potencjału redoks półogniwa Pt|Fe2+, Fe3+ zależy od stężenia molowego każdego z jonów (Fe2+ oraz Fe3+) i w temperaturze 25 oC wyraża się zależnością zwaną równaniem Nernsta w postaci:
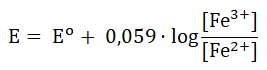
W wyrażeniu tym Eo to standardowy potencjał redoks półogniwa o wartości 0,771 V, natomiast [Fe3+] oraz [Fe2+] są stężeniami molowymi jonów potencjałotwórczych.
W temperaturze 25 oC zbudowano ogniwo chemiczne z dwóch półogniw Pt|Fe2+, Fe3+. W pierwszym z nich stężenie jonów Fe3+ było takie samo jak stężenie jonów Fe2+ w drugim półogniwie i wynosiło 0,5 mol·dm–3. Stężenia pozostałych jonów potencjałotwórczych w tych półogniwach odpowiadały stężeniu jonów chlorkowych w roztworze HCl o pH = 2.
Oblicz SEM opisanego ogniwa chemicznego w temperaturze 25 oC. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym
W stanie równowagi (gdy ogniwo chemiczne uległo wyczerpaniu) standardową siłę elektromotoryczną ogniwa w temperaturze 298 K opisuje wyrażenie:
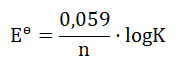
Wielkość K to stała równowagi reakcji redoks przebiegającej podczas pracy ogniwa, natomiast n to liczba moli elektronów wymienionych między utleniaczem i reduktorem.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz stałą równowagi reakcji w temperaturze 298 K, przebiegającej w pracującym ogniwie zbudowanym z półogniw – cynkowego oraz kadmowego. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone