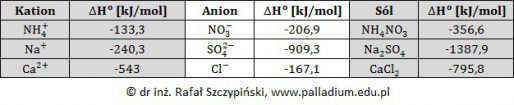
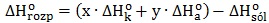Obliczanie wartości entalpii tworzenia tlenku chloru(IV)
W temperaturze bliskiej 333 K tlenek chloru(IV) ulega gwałtownej reakcji rozkładu:
2ClO2 → Cl2 + 2O2 ΔHo = -387 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie efektu cieplnego podanej reakcji chemicznej określ wartość entalpii tworzenia tlenku chloru(IV). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy reakcja kwasu solnego z roztworem zasady potasowej jest procesem endotermicznym czy egzotermicznym
Wraz ze wzrostem temperatury wzrasta wartość iloczynu jonowego wody (Kw), wielkości opisującej równowagę reakcji autodysocjacji wody:
2H2O ⇄ H3O+ + OH–
Napisz, czy w wyniku reakcji przebiegającej podczas wprowadzania wodnego roztworu kwasu solnego do wodnego roztworu wodorotlenku potasu następuje emisja energii cieplnej z układu do otoczenia. Uzasadnij odpowiedź. Odpowiedź: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie stosunku molowego oraz wagowego substratów w reakcji syntezy bromku żelaza(III)
Bromek żelaza(III) jest związkiem chemicznym, który można otrzymać w wyniku reakcji syntezy. Opisaną przemianę ilustruje równanie:
2Fe + 3Br2 → 2FeBr3
Określ molowy oraz wagowy stosunek stechiometryczny, w jakim reagują substraty podczas przebiegu opisanej reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie masy bromku żelaza(III) powstałego w wyniku reakcji żelaza ze stechiometryczną ilością bromu
Bromek żelaza(III) jest związkiem chemicznym, który można otrzymać w wyniku reakcji syntezy. Opisaną przemianę ilustruje równanie:
2Fe + 3Br2 → 2FeBr3
Oblicz masę bromku żelaza(III) powstałego po zmieszaniu 4,2 g żelaza ze stechiometryczną ilością bromu i zainicjowaniu reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczby atomów żelaza oraz cząsteczek bromu użytych w reakcji syntezy bromku żelaza(III)
Bromek żelaza(III) jest związkiem chemicznym, który można otrzymać w wyniku reakcji syntezy. Opisaną przemianę ilustruje równanie:
2Fe + 3Br2 → 2FeBr3
Określ, jaka liczba atomów żelaza oraz jaka liczba cząsteczek bromu powinna zostać użyta, w celu otrzymania 4 milimoli bromku żelaza(III) podczas opisanej przemiany. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby cząsteczek wody powstałej w reakcji tlenku ołowiu(IV) z kwasem solnym
Reakcja tlenku ołowiu(IV) z kwasem solnym przebiega zgodnie z równaniem stechiometrycznym:
PbO2 + 4HCl → PbCl2 + Cl2↑ + 2H2O
Oblicz, ile cząsteczek wody powstanie, jeśli reakcji ulegnie 95,6 g tlenku? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby moli tlenku ołowiu(IV) będącego substratem reakcji chemicznej
Reakcja tlenku ołowiu(IV) z kwasem solnym przebiega zgodnie z równaniem stechiometrycznym:
PbO2 + 4HCl → PbCl2 + Cl2↑ + 2H2O
Oblicz, ile moli tlenku należy użyć, aby powstało 6,95 g chlorku ołowiu(II)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby atomów miedzi biorących udział w reakcji chemicznej (równanie Clapeyrona)
Ze stężonym roztworem kwasu azotowego(V) miedź reaguje zgodnie z równaniem:
Cu + 4HNO3 ⟶ Cu(NO3)2 + 2NO2 + 2H2O
Oblicz, ile atomów miedzi przekształciło się w jony Cu2+, jeśli podczas przebiegu opisanej przemiany powstało 1,15 dm3 tlenku azotu(IV)? Pomiaru objętości dokonano w temperaturze 50 oC pod ciśnieniem 1005 hPa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości wydzielonego gazu w reakcji próbki węglanu sodu zawierającej określoną masę kationów
W zlewce umieszczono próbkę węglanu sodu, w którego sieci krystalicznej kationy ważyły 5,75 g. Na związek ten podziałano nadmiarem wodnego roztworu kwasu siarkowego(VI).
Oblicz, jaką objętość w warunkach normalnych zajął wydzielony gaz? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie, czy użyto wystarczającą masę węglanu wapnia, w celu uzyskania wymaganej objętości dwutlenku węgla
Produktami reakcji rozkładu węglanu wapnia są tlenek wapnia oraz dwutlenek węgla.
Na podstawie niezbędnych obliczeń ustal, czy rozkład 15 g węglanu wapnia pozwoli na uzyskanie takiej ilości dwutlenku węgla, jaka w warunkach normalnych zajmie objętość równą 4 dm3? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie odczynu wodnego roztworu na podstawie danych ilościowych substratów
Zmieszano wodny roztwór zawierający 15 g kwasu azotowego(V) z wodnym roztworem zawierającym 10 g wodorotlenku sodu.
Ustal odczyn uzyskanej mieszaniny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalenie, który z substratów został użyty w nadmiarze oraz masy tego nadmiaru
W tyglu porcelanowym umieszczono 1,68 g żelaza oraz 1,28 g siarki. W wyniku przebiegu ze 100% wydajnością reakcji chemicznej powstało 2,64 g FeS.
Ustal, który z substratów został użyty w nadmiarze oraz określ, jaki był to nadmiar. Wynik obliczeń wyraź w miligramach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone