Zależność pH roztworu aminy od stężenia roztworu
W pewnej temperaturze T stała równowagi procesu dysocjacji elektrolitycznej etanoaminy ma wartość 5∙10–4.
Oblicz, jak zmieni się stężenie molowe roztworu tej aminy, jeśli w wyniku rozcieńczenia wodą destylowaną w temperaturze T, pH tego roztworu obniży się od wartości równej 11 do 9. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH octu stołowego
Ocet stołowy jest 10-procentowym, wodnym roztworem kwasu etanowego, którego gęstość w temperaturze 25 ⁰C wynosi 1,02 g/cm3.
Oblicz wartość pH opisanego roztworu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH 1-procentowego roztworu kwasu solnego
Wodny roztwór kwasu solnego o stężeniu równym 1% nie jest klasyfikowany jako substancja niebezpieczna.
Oblicz wartość pH opisanego roztworu przyjmując, że jego gęstość równa jest gęstości wody destylowanej. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
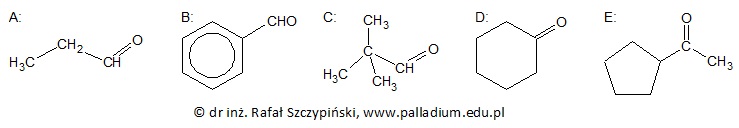
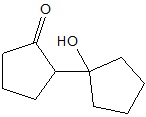
Określanie typu hybrydyzacji orbitali walencyjnych określonego atomu węgla oraz liczby wiązań sigma jakie tworzy
Aldehydy oraz ketony, których cząsteczki zawierają atom wodoru połączony z atomem węgla α (atomem węgla bezpośrednio połączonym z grupą karbonylową), w silnie alkalicznym środowisku ulegają reakcji kondensacji aldolowej. W przypadku aldehydów reakcja ta przebiega według ogólnego schematu:
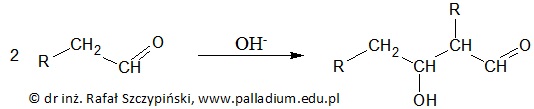
Opisany proces inicjowany jest przez oderwanie jednego z atomów wodoru, przyłączonego do atomu węgla α, co w konsekwencji prowadzi do utworzenia karboanionu. Rysunek poniżej przedstawia ogólny schemat budowy karboanionu powstałego w wyniku oderwania protonu od atomu węgla α cząsteczki aldehydu:
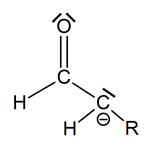
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2012.
Określ liczbę wiązań σ jakie tworzy atom węgla na którym zlokalizowany jest ładunek ujemny oraz typ hybrydyzacji (sp, sp2, sp3) jego orbitali walencyjnych. Liczba wiązań σ: Typ hybrydyzacji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu kwasu mrówkowego zawierającego określoną masę kwasu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Oblicz wartość pH uzyskanego w ten sposób roztworu kwasu mrówkowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, ile razy zmniejszyła się zawartość kwasu mrówkowego w wyniku ogrzewania jego wodnego roztworu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Opisany roztwór ogrzewano w pewnych warunkach i stwierdzono, że jego objętość zmniejszyła się o 50 cm3. Po zakończeniu ogrzewania i ochłodzeniu zawartości naczynia pozostały w nim roztwór miał pH równe 2,3. Określ, wykonując niezbędne obliczenia, ile razy zmniejszyła się zawartość kwasu mrówkowego w znajdującym się w zlewce roztworze, w wyniku ogrzewania jej zawartości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii tworzenia tlenku siarki(VI) na podstawie prawa Hessa
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zebranych w odpowiednim wierszu tabeli oblicz efekt cieplny (entalpię) towarzyszący utworzeniu jednego mola tlenku siarki(VI) z pierwiastków w postaci termodynamicznie trwałej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii procesu całkowitego uwodornienia buta-1,3-dienu
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zawartych w tabeli dotyczących procesu nr 2 określ wartość entalpii reakcji całkowitego uwodornienia jednego mola buta-1,3-dienu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii wieloetapowego procesu podczas otrzymywania tlenku siarki(VI)
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
W celu otrzymania tlenku siarki(VI) w procesie nr 1, spaleniu poddano 6,4 g siarki.
Zakładając 100% wydajność tej reakcji oraz 80% wydajność reakcji utleniania tlenku siarki(IV) określ, jaki będzie sumaryczny efekt cieplny (entalpia) procesu? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie stosunku molowego saletry i mocznika w nawozie azotowym
Nawozy sztuczne mogą stanowić mieszaniny o różnym składzie jakościowym oraz ilościowym. W przypadku nawozów azotowych często mamy do czynienia z mieszaninami soli kwasu azotowego(V) oraz mocznika – związku chemicznego o wzorze (NH2)2CO.
Ustal, w jakim stosunku molowym należy zmieszać saletrę amonową (NH4NO3) z mocznikiem, aby uzyskany nawóz zawierał 42% masowych azotu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie procentowego składu wagowego nawozu zawierającego mączkę dolomitową
Pewien nawóz sztuczny jest mieszaniną azotanu(V) amonu i siarczanu(VI) amonu z dodatkiem mączki dolomitowej. W nawozie tym siarka stanowi 6% masy, a azot w formie amonowej 17%.
Wiedząc, że mączka dolomitowa jest równomolową mieszaniną węglanów – wapnia oraz magnezu, oblicz zawartość procentową czterech opisanych składników nawozu. Wyniki obliczeń podaj z dokładnością do drugiego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone