Wskazanie probówek, w których przygotowano roztwory buforowe. Zadanie 13.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady są nazywane roztworami buforowymi. Przykładem jest bufor octanowy. Kwasem Brønsteda są w nim cząsteczki CH3COOH, a zasadą – jony CH3COO– pochodzące z całkowicie zdysocjowanej soli, np. octanu sodu. Wprowadzenie do roztworu buforowego mocnego kwasu skutkuje zmniejszeniem stężenia zasady i wzrostem stężenia sprzężonego z nią kwasu. Dodatek mocnej zasady prowadzi do zmniejszenia stężenia kwasu i wzrostu stężenia sprzężonej zasady. Wartość pH buforu praktycznie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Przeprowadzono doświadczenie, w którym zmieszano jednakowe objętości wodnych roztworów różnych substancji. Wszystkie roztwory miały jednakowe stężenie molowe. Mieszaniny przygotowano zgodnie z poniższym schematem.
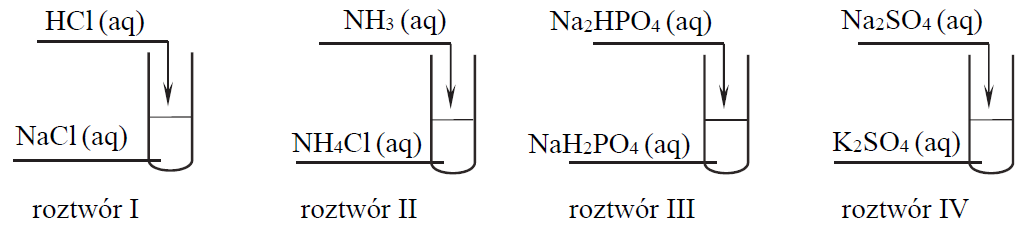
Które z przygotowanych roztworów są buforami? Napisz ich numery.
Obliczanie pH roztworu powstałego po zmieszaniu roztworu wodorotlenku baru z kwasem solnym. Zadanie 14.1. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
Zmieszano 100 cm3 wodnego roztworu Ba(OH)2 o stężeniu 0,2 mol∙dm–3 z 40 cm3 wodnego roztworu HCl o stężeniu 0,8 mol∙dm–3. W mieszaninie przebiegła reakcja opisana poniższym równaniem:
H3O+ + OH– → 2H2O
Oblicz pH powstałego roztworu w temperaturze 25 °C. W obliczeniach przyjmij, że objętość tego roztworu jest sumą objętości roztworów Ba(OH)2 i HCl. Wynik końcowy zaokrąglij do drugiego miejsca po przecinku.
Określenie stężeń molowych jonów baru oraz chlorkowych w roztworze po zmieszaniu roztworu wodorotlenku baru z kwasem solnym. Zadanie 14.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Zmieszano 100 cm3 wodnego roztworu Ba(OH)2 o stężeniu 0,2 mol∙dm–3 z 40 cm3 wodnego roztworu HCl o stężeniu 0,8 mol∙dm–3. W mieszaninie przebiegła reakcja opisana poniższym równaniem:
H3O+ + OH– → 2H2O
Wpisz do poniższej tabeli wartości stężenia molowego jonów baru i jonów chlorkowych w otrzymanym roztworze.
Szeregowanie jonów kompleksowych według wzrastającej ich trwałości. Zadanie 15. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Większość kationów metali występuje w roztworze wodnym w postaci jonów kompleksowych, tzw. akwakompleksów, w których cząsteczki wody otaczają jon metalu, czyli są ligandami. Dodanie do takiego roztworu reagenta, który z kationami danego metalu tworzy trwalsze kompleksy niż woda, powoduje wymianę ligandów. Kompleksy mogą mieć różne barwy, zależnie od rodzaju ligandów, np. jon Fe3+ tworzy z jonami fluorkowymi F– kompleks bezbarwny, a z jonami tiocyjanianowymi (rodankowymi) SCN– – krwistoczerwony. W dwóch probówkach znajdował się wodny roztwór chlorku żelaza(III). Do pierwszej probówki wsypano niewielką ilość stałego fluorku potasu, co poskutkowało odbarwieniem żółtego roztworu, a następnie do obu probówek dodano wodny roztwór rodanku potasu (KSCN). Stwierdzono, że tylko w probówce drugiej pojawiło się krwistoczerwone zabarwienie.
W badanych roztworach występowały jony kompleksowe żelaza(III):
I rodankowy, II fluorkowy, III akwakompleks
Uszereguj wymienione jony kompleksowe zgodnie ze wzrostem ich trwałości. Napisz w odpowiedniej kolejności numery, którymi je oznaczono. najmniejsza trwałość największa trwałość
Obliczanie procentu wagowego tlenku wapnia w mieszaninie poreakcyjnej uzyskanej po przerwaniu prażenia. Zadanie 16. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
W laboratorium tlenek wapnia można otrzymać ze szczawianu wapnia o wzorze CaC2O4. Szczawian wapnia ulega termicznemu rozkładowi, który przebiega zgodnie z poniższym równaniem:
CaC2O4 → CaCO3 + CO
Dalsze ogrzewanie, w wyższej temperaturze, prowadzi do rozkładu węglanu wapnia:
CaCO3 → CaO + CO2
Próbkę szczawianu wapnia o masie 12,8 g umieszczono w tyglu pod wyciągiem i poddano prażeniu. Po pewnym czasie proces przerwano, a następnie ostudzono tygiel, zważono jego zawartość i zbadano skład mieszaniny poreakcyjnej. Stwierdzono, że masa zawartości tygla zmalała o 6,32 g i że otrzymana mieszanina nie zawierała szczawianu wapnia.
Oblicz w procentach masowych zawartość tlenku wapnia w mieszaninie otrzymanej po przerwaniu prażenia. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem:
Wybór odpowiedniej blaszki oraz roztworu w celu przeprowadzenia reakcji chemicznej. Zadanie 17.1. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
W celu porównania reaktywności różnych metali wykonano doświadczenie, w którym płytkę z metalu M zważono i umieszczono w naczyniu zawierającym wodny roztwór pewnej soli. W wyniku zachodzącej reakcji roztwór się odbarwił. Płytkę wyjęto, opłukano wodą destylowaną, wysuszono i zważono ponownie. Ustalono, że w wyniku reakcji masa płytki zmalała.

Wybierz i podkreśl jeden symbol metalu w zestawie I i jeden wzór odczynnika w zestawie II, tak aby otrzymać schemat przeprowadzonego doświadczenia.
Zapis równania reakcji chemicznej przebiegającej po wprowadzeniu blaszki do roztworu. Zadanie 17.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
W celu porównania reaktywności różnych metali wykonano doświadczenie, w którym płytkę z metalu M zważono i umieszczono w naczyniu zawierającym wodny roztwór pewnej soli. W wyniku zachodzącej reakcji roztwór się odbarwił. Płytkę wyjęto, opłukano wodą destylowaną, wysuszono i zważono ponownie. Ustalono, że w wyniku reakcji masa płytki zmalała.

Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas doświadczenia.
Wskazanie probówek w których powstał osad wodorotlenku cynku. Zadanie 18.1. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym schemacie:
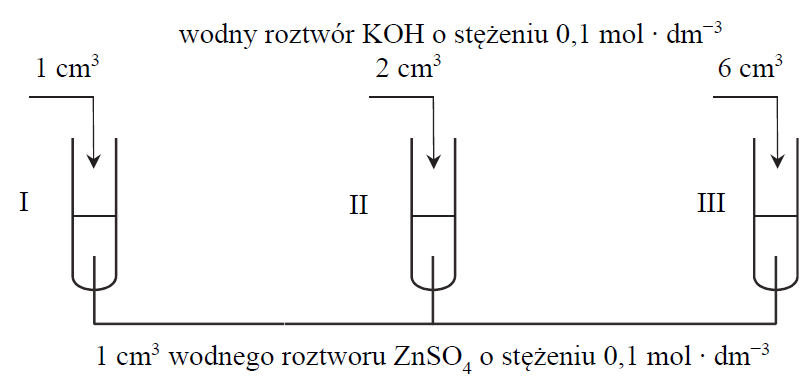
Podaj numery probówek, w których po zakończeniu doświadczenia pozostał biały osad wodorotlenku cynku.
Zapis jonowego skróconego równania reakcji chemicznej tworzenia jonu kompleksowego o liczbie koordynacyjnej 4. Zadanie 18.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym schemacie:

Napisz w formie jonowej skróconej równanie reakcji, która zaszła w probówce III. Uwzględnij, że jednym z produktów jest jon kompleksowy o liczbie koordynacyjnej 4.
Zapis obserwacji towarzyszących doświadczeniom z udziałem roztworów siarczanu(IV) sodu. Zadanie 19. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym schemacie:

W każdej z probówek zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Opisz zmiany, jakie zaobserwowano w probówkach. Probówka I: Probówka II:
Wybór słabego kwasu Brønsteda. Zadanie 20. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym schemacie:

W każdej z probówek zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Uzupełnij poniższe zdanie. Wybierz i podkreśl jedną odpowiedź spośród podanych w nawiasie. Na podstawie wyniku doświadczenia w probówce I można stwierdzić, że słabym kwasem Brønsteda jest (H2SO3 / HSO3– / SO32–)
Zapis równania reakcji chemicznej przebiegającej po dodaniu kwasu solnego do roztworu siarczanu(IV) sodu. Zadanie 21. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, którego przebieg zilustrowano na poniższym schemacie:

W każdej z probówek zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Napisz, jaką właściwość kwasu siarkowego(IV) potwierdził wynik doświadczenia w probówce II. Napisz w formie jonowej skróconej równanie reakcji, która zaszła w probówce II po dodaniu roztworu HCl i była przyczyną obserwowanych zmian. Kwas siarkowy(IV) jest słabszy niż kwas chlorowodorowy i jest kwasem . Równanie reakcji:
Zapis równań reakcji monobromowania dwóch węglowodorów nasyconych. Zadanie 22. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
Dwa węglowodory nasycone A i B mają w cząsteczkach po pięć atomów węgla. Cząsteczka jednego z tych węglowodorów ma budowę cykliczną. W cząsteczce węglowodoru A wszystkie atomy węgla mają jednakową rzędowość. Węglowodory A i B ulegają bromowaniu na świetle według mechanizmu substytucji rodnikowej. Każdy z nich tworzy wyłącznie jedną monobromopochodną.
Napisz równania reakcji monobromowania węglowodorów A i B. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Równanie reakcji monobromowania węglowodoru A: Równanie reakcji monobromowania węglowodoru B:
Zapis wzorów półstrukturalnych produktów reakcji węglowodoru z chlorowodorem. Zadanie 23.1. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono reakcję addycji, w której związek X o wzorze sumarycznym C4H8 przereagował z chlorowodorem w stosunku molowym 1:1. W wyniku opisanej przemiany powstały dwa związki, z których jeden ma cząsteczki chiralne i występuje w postaci enancjomerów, a cząsteczki drugiego związku są achiralne.
Napisz wzory półstrukturalne (grupowe) obu produktów reakcji związku X z chlorowodorem. Wzór związku, którego cząsteczki są chiralne: Wzór związku, którego cząsteczki są achiralne:
Rysowanie wzorów pary enancjomerów. Zadanie 23.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Przeprowadzono reakcję addycji, w której związek X o wzorze sumarycznym C4H8 przereagował z chlorowodorem w stosunku molowym 1:1. W wyniku opisanej przemiany powstały dwa związki, z których jeden ma cząsteczki chiralne i występuje w postaci enancjomerów, a cząsteczki drugiego związku są achiralne.
Uzupełnij poniższy schemat, tak aby przedstawiał budowę obu enancjomerów chiralnego produktu reakcji związku X z chlorowodorem.