Wskazanie, czy jony jodkowe oraz dichromianowe(VI) pełnią taką samą funkcję w podanych reakcjach redoks. Zadanie 19.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Zawartość jonów dichromianowych(VI) w wodnym roztworze można określić dzięki zastosowaniu metody pośredniej. W pierwszym etapie dodaje się roztwór jodku potasu i kwas siarkowy(VI). Zachodzi wtedy reakcja opisana równaniem:
Cr2O72– + 6I– + 14H+ → 2Cr3+ + 3I2 + 7H2O
W drugim etapie do otrzymanej mieszaniny dodaje się roztwór tiosiarczanu sodu i wtedy jony S2O32– reagują z jodem:
I2 + 2S2O32– → 2I– + S4O62–
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, Warszawa 2007.
Rozstrzygnij, czy jony dichromianowe(VI) w etapie pierwszym oraz jod w etapie drugim pełnią taką samą funkcję (utleniacza albo reduktora). Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczanie masy dichromianu(VI) potasu w badanej próbce. Zadanie 19.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Zawartość jonów dichromianowych(VI) w wodnym roztworze można określić dzięki zastosowaniu metody pośredniej. W pierwszym etapie dodaje się roztwór jodku potasu i kwas siarkowy(VI). Zachodzi wtedy reakcja opisana równaniem:
Cr2O72– + 6I– + 14H+ → 2Cr3+ + 3I2 + 7H2O
W drugim etapie do otrzymanej mieszaniny dodaje się roztwór tiosiarczanu sodu i wtedy jony S2O32– reagują z jodem:
I2 + 2S2O32– → 2I– + S4O62–
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, Warszawa 2007.
Aby określić zawartość jonów dichromianowych(VI) w próbce, przeprowadzono opisane reakcje. W reakcji z jodem wzięło udział 20,4 cm3 wodnego roztworu tiosiarczanu sodu o stężeniu 0,10 mol∙dm–3.
Oblicz, ile gramów dichromianu(VI) potasu zawierała badana próbka. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100% oraz że masa molowa dichromianu(VI) potasu MK2Cr2O7 = 294 g·mol–1.
Wybór poprawnych określeń dotyczących struktury cząsteczek etanu, etenu oraz etynu. Zadanie 20. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Poniżej przedstawiono wartości energii wiązań chemicznych pomiędzy atomami węgla oraz długości tych wiązań w cząsteczkach etanu, etenu i etynu.
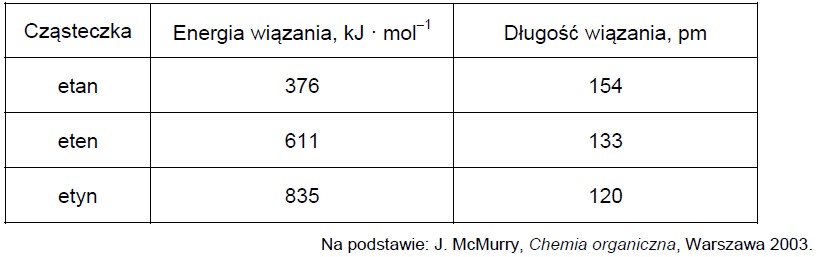
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. 1. W cząsteczce etenu orbitalom walencyjnym atomów węgla przypisuje się hybrydyzację (sp3 / sp2). Podwójne wiązanie węgiel – węgiel w cząsteczce etenu powstaje w wyniku uwspólnienia (dwóch / czterech) elektronów. 2. Cząsteczki etynu są (liniowe / trygonalne). 3. Wraz ze wzrostem długości wiązania (rośnie / maleje) wartość energii niezbędnej do rozerwania wiązania.
Zapis wzoru elektronowego kreskowego produktu reakcji monochlorowania etanu. Zadanie 21. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Jednym z produktów reakcji etanu z chlorem oraz produktem reakcji etenu z chlorowodorem jest ten sam związek organiczny.
Narysuj wzór elektronowy opisanego związku. Zaznacz kreskami wszystkie wspólne i wolne pary elektronowe.
Ustalanie wzoru sumarycznego węglowodoru na podstawie danych z reakcji jego spalania. Zadanie 22. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Do całkowitego spalenia próbki zawierającej 8,43·1022 cząsteczek pewnego węglowodoru zużyto 15,68 dm3 tlenu odmierzonego w warunkach normalnych. W reakcji wydzieliło się 18,48 g tlenku węgla(IV).
Ustal na podstawie obliczeń wzór sumaryczny tego węglowodoru.
Zapis równania reakcji mononitrowania nitrobenzenu. Zadanie 23. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.
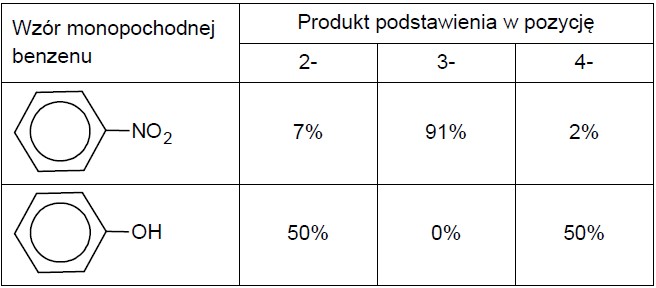
Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.
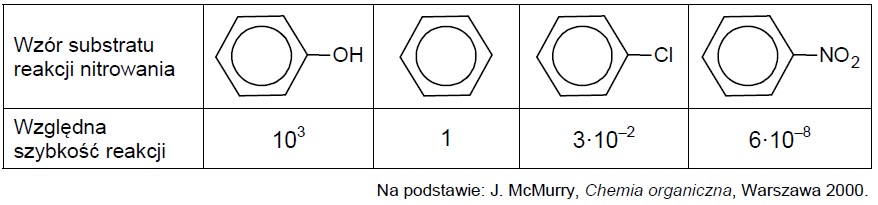
Napisz równanie reakcji nitrowania mononitrobenzenu prowadzącej do powstania głównego produktu organicznego oraz określ mechanizm (elektrofilowy, nukleofilowy, rodnikowy) tej reakcji. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Równanie reakcji: Mechanizm:
Zapis wzorów półstrukturalnych izomerycznych produktów mononitrowania fenolu. Zadanie 24. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.

Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.

Napisz wzory półstrukturalne (grupowe) lub uproszczone izomerycznych produktów mononitrowania fenolu.
Ocena poprawności zdań dotyczących reakcji związków aromatycznych. Zadanie 25. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
W cząsteczce benzenu wszystkie atomy węgla są równocenne, natomiast w cząsteczkach pochodnych benzenu, w których jeden atom wodoru został zastąpiony innym podstawnikiem, następuje zróżnicowanie właściwości chemicznych atomów węgla tworzących pierścień. To zróżnicowanie uwidacznia się m.in. w przebiegu reakcji nitrowania. W poniższej tabeli przedstawiono, z jaką wydajnością powstają izomeryczne produkty nitrowania dwóch monopochodnych benzenu: nitrobenzenu i fenolu.

Rodzaj podstawnika już przyłączonego do pierścienia wpływa także na reaktywność tego pierścienia. Poniższe zestawienie ilustruje wpływ podstawnika na względną szybkość reakcji nitrowania.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeżeli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Atom chloru jest podstawnikiem aktywującym pierścień aromatyczny w reakcji nitrowania. 2. Szybkość reakcji nitrowania fenolu jest tysiąc razy większa od szybkości reakcji nitrowania benzenu. 3. W reakcji nitrowania najbardziej reaktywny spośród wymienionych związków jest nitrobenzen.
Zapis równań reakcji przemian oznaczonych na schemacie ciągu procesów. Zadanie 26. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Poniżej przedstawiono ciąg przemian chemicznych, w których biorą udział związki organiczne, umownie oznaczone literami A, B, C i D, a produktem ostatecznym jest 2-bromopropan. Związek B jest izomerem, w którym atom chloru jest przyłączony do atomu węgla o niższej rzędowości.
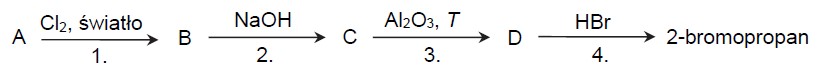
Napisz równania reakcji oznaczonych numerami 1 i 3. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Reakcja 1.: Reakcja 3.:
Wskazanie typu reakcji oraz mechanizmu. Zadanie 27. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Poniżej przedstawiono ciąg przemian chemicznych, w których biorą udział związki organiczne, umownie oznaczone literami A, B, C i D, a produktem ostatecznym jest 2-bromopropan. Związek B jest izomerem, w którym atom chloru jest przyłączony do atomu węgla o niższej rzędowości.
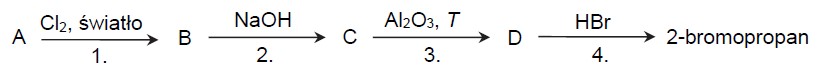
Uzupełnij poniższą tabelę. Określ typ reakcji 2. (addycja, eliminacja, substytucja) oraz jej mechanizm (rodnikowy, elektrofilowy, nukleofilowy).
Określanie rzędowości alkoholi uzyskanych w wyniku kilku procesów chemicznych. Zadanie 28. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Mieszaninę 1 zawierającą trzy izomeryczne alkohole A, B i C o wzorze sumarycznym C4H10O poddano łagodnemu utlenianiu za pomocą tlenku miedzi(II). Następnie otrzymaną mieszaninę 2 utleniono tlenem z powietrza. W wyniku opisanych przemian otrzymano mieszaninę 3, która zawierała trzy różne związki organiczne:
– alkohol B;
– produkt dwóch kolejnych przemian, którym uległ alkohol C;
– produkt jednej przemiany alkoholu A.
Określ rzędowość każdego z alkoholi i wpisz do tabeli litery, którymi je oznaczono.
Rysowanie wzorów półstrukturalnych uzyskanych w wyniku kilku procesów chemicznych. Zadanie 29. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Mieszaninę 1 zawierającą trzy izomeryczne alkohole A, B i C o wzorze sumarycznym C4H10O poddano łagodnemu utlenianiu za pomocą tlenku miedzi(II). Następnie otrzymaną mieszaninę 2 utleniono tlenem z powietrza. W wyniku opisanych przemian otrzymano mieszaninę 3, która zawierała trzy różne związki organiczne:
– alkohol B;
– produkt dwóch kolejnych przemian, którym uległ alkohol C;
– produkt jednej przemiany alkoholu A.
Produkt przemian alkoholu C nie zawiera w swojej cząsteczce III-rzędowych atomów węgla.
Napisz wzory półstrukturalne (grupowe) trzech związków organicznych wchodzących w skład mieszaniny 3.
Opisanie przyczyny dobrej rozpuszczalności w wodzie aldehydów i ketonów o małych masach cząsteczkowych. Zadanie 30. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Aldehydy i ketony o małych masach cząsteczkowych, np. metanal i propanon, są rozpuszczalne w wodzie. W miarę wzrostu masy cząsteczkowej rozpuszczalność aldehydów i ketonów w wodzie maleje.
Napisz, co jest przyczyną dobrej rozpuszczalności metanalu i propanonu w wodzie, oraz opisz przyczynę zmniejszania się rozpuszczalności aldehydów i ketonów w wodzie wraz ze wzrostem masy cząsteczkowej tych związków. Odnieś się do budowy cząsteczek związków karbonylowych. Dobra rozpuszczalność metanalu i propanonu w wodzie wynika z: Wraz ze wzrostem masy cząsteczkowej aldehydów i ketonów rozpuszczalność tych związków w wodzie zmniejsza się, ponieważ:
Zapis nazwy produktu reakcji kondensacji aldolowej etanalu. Zadanie 31.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Reakcja aldolowa, przebiegająca w środowisku rozcieńczonej zasady, prowadzi do połączenia dwóch cząsteczek aldehydu lub ketonu i utworzenia wiązania między atomem węgla α jednej cząsteczki i karbonylowym atomem węgla drugiej cząsteczki. Produktem jest β-hydroksyaldehyd (aldol) lub β-hydroksyketon. Reakcji ulegają wszystkie aldehydy i ketony zawierające atomy wodoru α, czyli atom wodoru zlokalizowany przy atomie węgla połączonym z grupą aldehydową lub ketonową. Jeśli etanal zostanie poddany działaniu zasady, takiej jak etanolan sodu lub wodorotlenek sodu, wówczas zachodzi szybka, odwracalna reakcja:
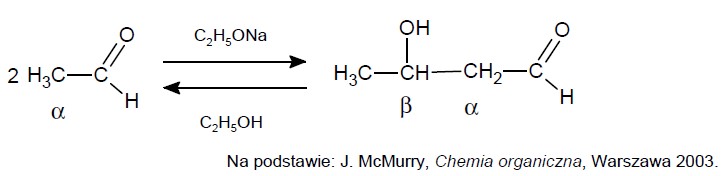
Napisz nazwę systematyczną produktu reakcji aldolowej etanalu.
Zapis równania reakcji aldolowej propanalu. Zadanie 31.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Reakcja aldolowa, przebiegająca w środowisku rozcieńczonej zasady, prowadzi do połączenia dwóch cząsteczek aldehydu lub ketonu i utworzenia wiązania między atomem węgla α jednej cząsteczki i karbonylowym atomem węgla drugiej cząsteczki. Produktem jest β-hydroksyaldehyd (aldol) lub β-hydroksyketon. Reakcji ulegają wszystkie aldehydy i ketony zawierające atomy wodoru α, czyli atom wodoru zlokalizowany przy atomie węgla połączonym z grupą aldehydową lub ketonową. Jeśli etanal zostanie poddany działaniu zasady, takiej jak etanolan sodu lub wodorotlenek sodu, wówczas zachodzi szybka, odwracalna reakcja:

Napisz równanie reakcji aldolowej propanalu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.

