Wybór poprawnych określeń dotyczących reguły przekory w reakcji syntezy amoniaku. Zadanie 7. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Poniżej przedstawiono równanie reakcji syntezy amoniaku.
N2 + 3H2 ⇄ 2NH3 ΔH = -91,8 kJ
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Wzrost temperatury w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku. Dodanie do reaktora większej ilości wodoru przyczyni się do (spadku / wzrostu) ilości amoniaku w mieszaninie poreakcyjnej. Obniżenie ciśnienia w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku.
Ustalanie wzoru hydratu na podstawie przeprowadzonej reakcji chemicznej. Zadanie 8. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm3 roztworu, po czym dodano do niego 50,0 cm3 roztworu azotanu(V) baru o stężeniu 0,600 mol·dm–3. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe: MNa2SO4 = 142 g·mol–1 MBaSO4 = 233 g·mol–1
Wyjaśnienie większej aktywności metalu z pośród wapnia i magnezu. Zadanie 9. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Do dwóch zlewek zawierających jednakowe objętości wody o temperaturze t = 20 °C dodano:
• do zlewki I – próbkę metalicznego magnezu
• do zlewki II – próbkę metalicznego wapnia.
Tylko w jednej zlewce zaobserwowano objawy reakcji chemicznej.
Napisz w formie jonowej równanie reakcji zachodzącej podczas opisanego doświadczenia. Wyjaśnij przyczynę różnej aktywności chemicznej badanych metali. Równanie reakcji: Wyjaśnienie:
Uszeregowanie soli według wzrastającego pH ich wodnych roztworów. Zadanie 10. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
Zapis równania reakcji zachodzącej w wodnym roztworze chlorku amonu. Zadanie 11.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
Wskazanie jaką rolę pełni woda w teorii Brønsteda w wodnym roztworze fluorku sodu. Zadanie 11.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Obliczanie pH roztworu kwasu solnego. Zadanie 12. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Odmierzono 10,0 cm3 kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm–3, a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm3.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2015.
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie charakteru chemicznego wodorotlenku glinu z zapisem równań reakcji chemicznych. Zadanie 13. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
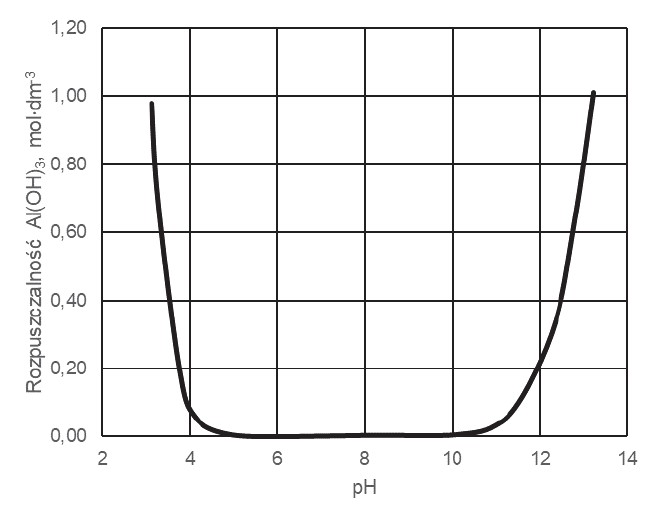
Na podstawie: G. Charlot, Analiza nieorganiczna jakościowa, Warszawa 1976.
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu. Charakter chemiczny: Równania reakcji:
Rozszyfrowanie roztworów, których roztwory mieszano wzajemnie. Zadanie 14. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
W trzech ponumerowanych probówkach znajdowały się bezbarwne wodne roztwory: azotanu(V) srebra(I), chlorku glinu i wodorotlenku potasu. Roztwory mieszano ze sobą, a obserwacje z przeprowadzonych doświadczeń przedstawiono w poniższej tabeli.
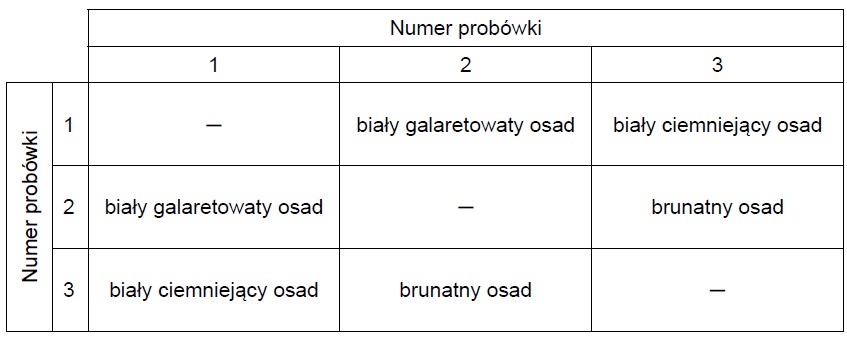
Wpisz do tabeli wzory substancji, których roztwory znajdowały się w probówkach 1–3.
Zapis równań reakcji chemicznych odzyskiwania amoniaku oraz kalcynacji wodorowęglanu sodu. Zadanie 15. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.). Równanie 1.: Równanie 2.:
Opis zmian wyglądu płytki oraz roztworu po wprowadzeniu płytki metalu do roztworu. Zadanie 16.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).
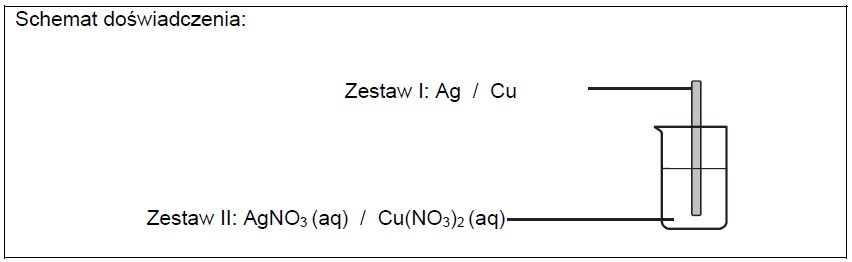
Zaprojektuj doświadczenie, podczas którego można zaobserwować zmiany świadczące o przebiegu reakcji chemicznej. Uzupełnij schemat doświadczenia – wybierz i podkreśl po jednym odczynniku w zestawach I i II oraz opisz zmiany zaobserwowane podczas przeprowadzonego doświadczenia. Zestaw I: Zestaw II: Zmiana wyglądu płytki: Zmiana wyglądu roztworu:
Wybór poprawnych określeń dotyczących zdolności utleniających jonów miedzi(II) oraz jonów srebra. Zadanie 16.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).

Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Przebieg doświadczenia potwierdził, że miedź jest (silniejszym / słabszym) reduktorem niż srebro oraz że silniejsze właściwości utleniające mają kationy (Cu2+ / Ag+). Potencjał E° półogniwa Cu|Cu2+ jest (niższy / wyższy) od potencjału półogniwa Ag|Ag+.
Ocena jak zmieniły się stężenia jonów w roztworze w wyniku przeprowadzonego doświadczenia. Zadanie 16.3. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).

Rozstrzygnij, czy podczas przeprowadzonego doświadczenia sumaryczne stężenie molowe kationów oraz sumaryczne stężenie molowe anionów się zmieniły (wzrosły albo zmalały), czy też nie uległy zmianie. Uzupełnij poniższe zdania i uzasadnij odpowiedź. Stężenie molowe kationów w roztworze (wzrosło / zmalało / nie uległo zmianie). Stężenie molowe anionów w roztworze (wzrosło / zmalało / nie uległo zmianie).
Uzasadnienie:
Uzasadnienie:
Zapis wzorów produktów reakcji tlenku manganu(IV) z kwasem solnym oraz z kwasem siarkowym(VI). Zadanie 17. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
Podaj wzory wszystkich produktów reakcji tlenku manganu(IV):
• z kwasem solnym:
• z kwasem siarkowym(VI):
Bilans jonowo-elektronowy reakcji tlenku manganu(IV) z tlenem w środowisku zasadowym. Zadanie 18. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
Tlenek manganu(IV) reaguje z tlenem w środowisku zasadowym. W reakcji powstają sole manganu(VI).
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas reakcji tlenku manganu(IV) z tlenem w środowisku zasadowym (NaOH). Napisz w formie cząsteczkowej sumaryczne równanie zachodzącej reakcji. Równanie procesu redukcji: Równanie procesu utlenienia: Sumaryczne równanie reakcji:

