Wskazanie nazwy zjawiska stanowiącego podstawę opisanego w treści zadania procesu. Zadanie 55. Informator CKE chemia 2023 rozszerzony (1 punkt)
Poniżej przedstawiono opis jednej z najnowocześniejszych, a jednocześnie powszechnie stosowanej metody pokrywania karoserii samochodowych powłokami antykorozyjnymi lub dekoracyjnymi.
Do malowania wykorzystuje się farby tworzące z wodą układy koloidalne. Malowanie zachodzi w wyniku przepływu prądu elektrycznego. W polu elektrycznym obdarzone ładunkiem elektrycznym koloidalne cząstki farby poruszają się do elektrody, którą jest karoseria samochodu. Proces nakładania powłoki prowadzi się z zastosowaniem prądu stałego o określonym napięciu.
Zaznacz nazwę zjawiska stanowiącego podstawę opisanego procesu.
A. elektroliza
B. elektroforeza
C. ekstrakcja
D. sedymentacja
Wybór polimeru, który będzie najłatwiej ulegał biodegradacji. Zadanie 56. Informator CKE chemia 2023 rozszerzony (1 punkt)
Wobec ciągle wzrastającej ilości odpadów, w których duży udział mają tworzywa sztuczne, coraz bardziej istotnym kryterium doboru i stosowania polimerów staje się ich zdolność do biodegradacji. Ten proces polega na rozkładzie makrocząsteczek pod wpływem mikroorganizmów takich jak drożdże lub bakterie. Produktami całkowitej biodegradacji są zwykle gazy, np. CO2, CH4, NH3 i para wodna.
Czynniki sprzyjające biodegradacji to niska masa cząsteczkowa polimeru, jego właściwości hydrofilowe oraz obecność grup funkcyjnych podatnych na enzymatyczną hydrolizę lub utlenianie.
Poniżej przedstawiono wzory trzech polimerów: dwa z nich powstają w wyniku procesów polimeryzacji, a jeden – w reakcji polikondensacji.
Wybierz spośród przedstawionych polimerów ten, który będzie najłatwiej ulegał biodegradacji, i napisz równanie reakcji jego otrzymywania z odpowiedniego monomeru.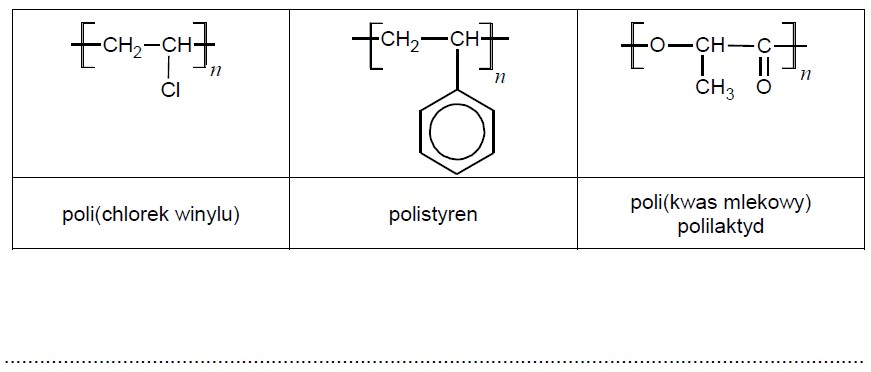
Zapis sumarycznego równania reakcji biegnącej w ogniwie paliwowym. Zadanie 57.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Napisz sumaryczne równanie reakcji biegnącej w opisanym ogniwie paliwowym.
Wybór właściwych wyrażeń opisujących ogniwo paliwowe. Zadanie 57.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. W opisanym ogniwie paliwowym na katodzie biegnie reakcja (1 / 2), a na anodzie biegnie reakcja (1 / 2). W sumarycznym procesie bierze udział (4 / 6 / 12) moli elektronów w przeliczeniu na 1 mol reduktora.
Obliczanie efektu cieplnego sumarycznego procesu przebiegającego w ogniwie paliwowym. Zadanie 58. Informator CKE chemia 2023 rozszerzony (2 punkty)
W pracującym ogniwie paliwowym zasilanym bezpośrednio metanolem na elektrodach biegną reakcje chemiczne:
reakcja 1: O2 (g) + 4H+ (aq) + 4ē → 2H2O (c)
reakcja 2: CH3OH (g) + H2O (c) → CO2 (g) + 6H+ (aq) + 6ē
Oblicz efekt cieplny sumarycznego procesu przebiegającego w opisanym ogniwie paliwowym w przeliczeniu na 1 mol metanolu. Przyjmij, że w warunkach pracy ogniwa: ΔHtw. (CH3OH (g)) = – 201,0 kJ∙mol–1, ΔHtw. (H2O (c)) = – 285,8 kJ∙mol–1, ΔHtw. (CO2 (g)) = – 393,5 kJ∙mol–1.
Zapis symbolu pierwiastka chemicznego oraz określenie bloku energetycznego na podstawie skróconej konfiguracji elektronowej kationu. Zadanie 1.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar] 3d10.
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek.
Zapis klatkowy pełnej konfiguracji elektronowej rozszyfrowanego pierwiastka. Zadanie 1.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar] 3d10.
Uzupełnij poniższy schemat. Przedstaw pełną konfigurację elektronową atomu (w stanie podstawowym) pierwiastka X. Zastosuj schemat klatkowy. W zapisie uwzględnij numery powłok i symbole podpowłok.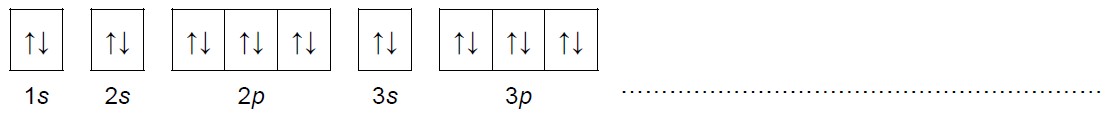
Wyjaśnienie, dlaczego energia jonizacji wodoru jest dużo większa niż pozostałych pierwiastków pierwszej grupy układu okresowego. Zadanie 2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
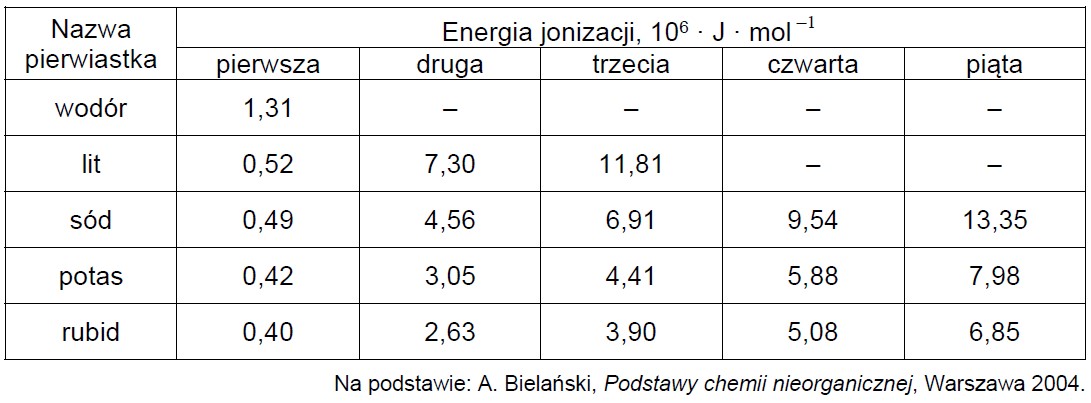
Wyjaśnij, dlaczego wartość pierwszej energii jonizacji atomu wodoru jest dużo większa niż wartość pierwszej energii jonizacji atomów kolejnych pierwiastków pierwszej grupy.
Wybór poprawnych określeń w nawiasach, w zdaniach dotyczących energii jonizacji. Zadanie 3. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.

Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Pierwsza energia jonizacji litowca jest (mniejsza / większa) niż druga energia jonizacji, ponieważ: oraz • przyciąganie przez jądro elektronu z przedostatniej powłoki jest (silniejsze / słabsze) niż przyciąganie elektronu z powłoki ostatniej.
• (łatwiej / trudniej) oderwać elektron od jonu naładowanego dodatnio niż od obojętnego atomu
Ocena poprawności zdań dotyczących energii jonizacji pierwiastków. Zadanie 4. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W grupie pierwiastków: lit, sód i rubid, obserwujemy, że im mniejsza elektroujemność, tym większa jest wartość pierwszej energii jonizacji. 2. W grupie pierwiastków: sód, potas i rubid, obserwujemy, że im większy promień atomu, tym mniejsza jest wartość pierwszej energii jonizacji. 3. Wartości czwartej i piątej energii jonizacji potasu dotyczą elektronów należących do różnych powłok.
Obliczanie rozpuszczalności sacharozy w temperaturze 80 stopni Celsjusza. Zadanie 5. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Sacharoza dobrze rozpuszcza się w wodzie, a jej rozpuszczalność w dużym stopniu zależy od temperatury.
Przygotowano nasycony wodny roztwór sacharozy w temperaturze 80 °C. Następnie ochłodzono go do temperatury 20 °C i stwierdzono, że wykrystalizowało 1590 g sacharozy, a roztwór, który pozostał po krystalizacji, miał masę 3040 g.
Oblicz rozpuszczalność sacharozy (w gramach na 100 gramów wody) w temperaturze 80 °C, jeśli w temperaturze 20 °C jest ona równa 204 g na 100 g wody. Na podstawie: W. Mizerski, Małe tablice chemiczne, Warszawa 1997.
Wybór poprawnych określeń dotyczących katalizatora. Zadanie 6. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Działanie katalizatora prowadzi do (obniżenia / podwyższenia) energii aktywacji katalizowanej reakcji. Obecność katalizatora (wpływa / nie wpływa) na wydajność procesu. Katalizatory (zmieniają szybkość / nie zmieniają szybkości), z jaką układ osiąga stan równowagi.