Zapis równania reakcji zachodzącej w wodnym roztworze chlorku amonu. Zadanie 11.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
Wskazanie jaką rolę pełni woda w teorii Brønsteda w wodnym roztworze fluorku sodu. Zadanie 11.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Obliczanie pH roztworu kwasu solnego. Zadanie 12. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Odmierzono 10,0 cm3 kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm–3, a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm3.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2015.
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie charakteru chemicznego wodorotlenku glinu z zapisem równań reakcji chemicznych. Zadanie 13. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
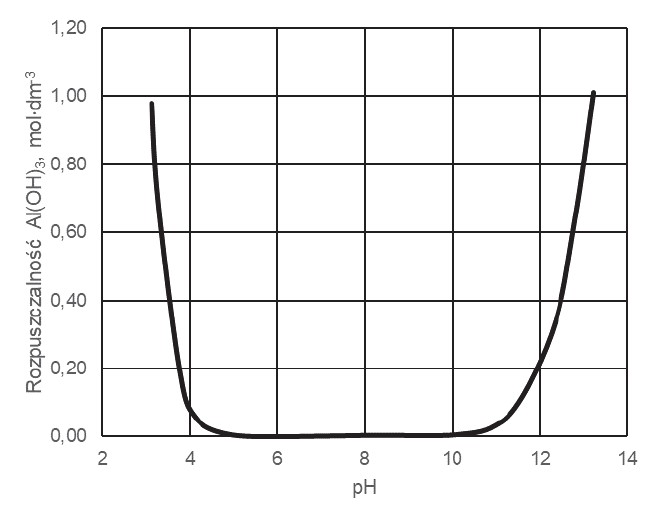
Na podstawie: G. Charlot, Analiza nieorganiczna jakościowa, Warszawa 1976.
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu. Charakter chemiczny: Równania reakcji:
Rozszyfrowanie roztworów, których roztwory mieszano wzajemnie. Zadanie 14. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
W trzech ponumerowanych probówkach znajdowały się bezbarwne wodne roztwory: azotanu(V) srebra(I), chlorku glinu i wodorotlenku potasu. Roztwory mieszano ze sobą, a obserwacje z przeprowadzonych doświadczeń przedstawiono w poniższej tabeli.
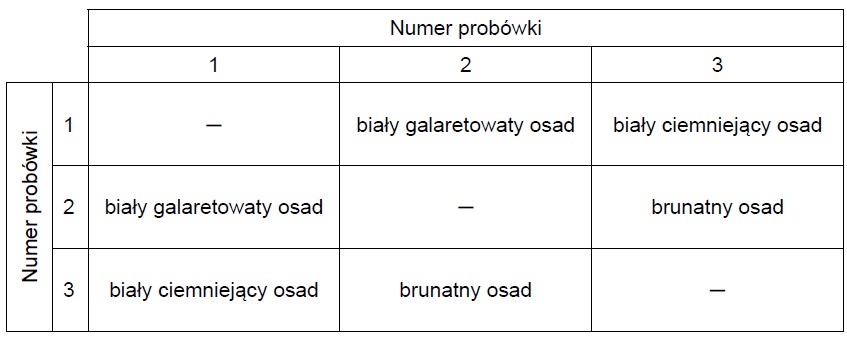
Wpisz do tabeli wzory substancji, których roztwory znajdowały się w probówkach 1–3.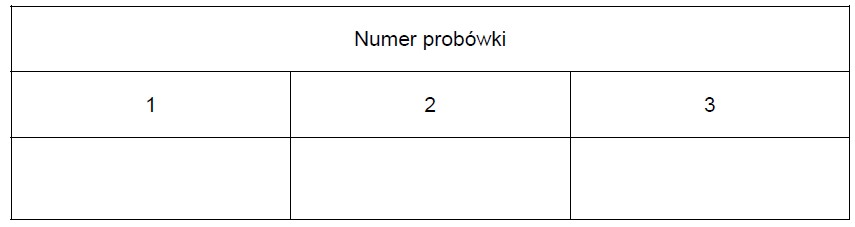
Zapis równań reakcji chemicznych odzyskiwania amoniaku oraz kalcynacji wodorowęglanu sodu. Zadanie 15. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Węglan sodu to jeden z najważniejszych produktów nieorganicznego przemysłu chemicznego. Jest otrzymywany metodą amoniakalną, w której surowcami są amoniak, chlorek sodu oraz węglan wapnia. Proces składa się z wielu etapów. Jednym z produktów ubocznych okazuje się chlorek amonu, z którego, w wyniku działania wodorotlenkiem wapnia, odzyskiwany jest amoniak. Ostateczny produkt (węglan sodu) powstaje w wyniku ogrzewania wodorowęglanu sodu w procesie zwanym kalcynacją.
Napisz w formie cząsteczkowej równanie reakcji odzyskiwania amoniaku z chlorku amonu (równanie 1.) oraz równanie reakcji kalcynacji wodorowęglanu sodu (równanie 2.). Równanie 1.: Równanie 2.:
Opis zmian wyglądu płytki oraz roztworu po wprowadzeniu płytki metalu do roztworu. Zadanie 16.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).
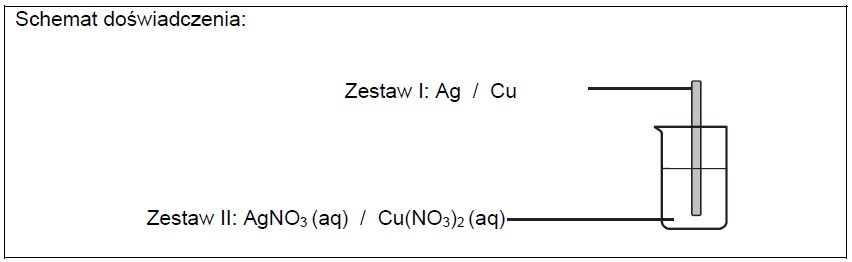
Zaprojektuj doświadczenie, podczas którego można zaobserwować zmiany świadczące o przebiegu reakcji chemicznej. Uzupełnij schemat doświadczenia – wybierz i podkreśl po jednym odczynniku w zestawach I i II oraz opisz zmiany zaobserwowane podczas przeprowadzonego doświadczenia. Zestaw I: Zestaw II: Zmiana wyglądu płytki: Zmiana wyglądu roztworu:
Wybór poprawnych określeń dotyczących zdolności utleniających jonów miedzi(II) oraz jonów srebra. Zadanie 16.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).

Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Przebieg doświadczenia potwierdził, że miedź jest (silniejszym / słabszym) reduktorem niż srebro oraz że silniejsze właściwości utleniające mają kationy (Cu2+ / Ag+). Potencjał E° półogniwa Cu|Cu2+ jest (niższy / wyższy) od potencjału półogniwa Ag|Ag+.
Ocena jak zmieniły się stężenia jonów w roztworze w wyniku przeprowadzonego doświadczenia. Zadanie 16.3. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Masz do dyspozycji: srebrzystoszarą płytkę ze srebra i czerwonoróżową płytkę miedzianą oraz wodne roztwory azotanu(V) srebra(I) i azotanu(V) miedzi(II).

Rozstrzygnij, czy podczas przeprowadzonego doświadczenia sumaryczne stężenie molowe kationów oraz sumaryczne stężenie molowe anionów się zmieniły (wzrosły albo zmalały), czy też nie uległy zmianie. Uzupełnij poniższe zdania i uzasadnij odpowiedź. Stężenie molowe kationów w roztworze (wzrosło / zmalało / nie uległo zmianie). Stężenie molowe anionów w roztworze (wzrosło / zmalało / nie uległo zmianie).
Uzasadnienie:
Uzasadnienie:
Zapis wzorów produktów reakcji tlenku manganu(IV) z kwasem solnym oraz z kwasem siarkowym(VI). Zadanie 17. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
Podaj wzory wszystkich produktów reakcji tlenku manganu(IV):
• z kwasem solnym:
• z kwasem siarkowym(VI):
Bilans jonowo-elektronowy reakcji tlenku manganu(IV) z tlenem w środowisku zasadowym. Zadanie 18. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Tlenek manganu(IV) w reakcjach utleniania-redukcji może pełnić funkcję reduktora lub utleniacza.
Tlenek manganu(IV) reaguje z tlenem w środowisku zasadowym. W reakcji powstają sole manganu(VI).
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas reakcji tlenku manganu(IV) z tlenem w środowisku zasadowym (NaOH). Napisz w formie cząsteczkowej sumaryczne równanie zachodzącej reakcji. Równanie procesu redukcji: Równanie procesu utlenienia: Sumaryczne równanie reakcji:
Wskazanie, czy jony jodkowe oraz dichromianowe(VI) pełnią taką samą funkcję w podanych reakcjach redoks. Zadanie 19.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Zawartość jonów dichromianowych(VI) w wodnym roztworze można określić dzięki zastosowaniu metody pośredniej. W pierwszym etapie dodaje się roztwór jodku potasu i kwas siarkowy(VI). Zachodzi wtedy reakcja opisana równaniem:
Cr2O72– + 6I– + 14H+ → 2Cr3+ + 3I2 + 7H2O
W drugim etapie do otrzymanej mieszaniny dodaje się roztwór tiosiarczanu sodu i wtedy jony S2O32– reagują z jodem:
I2 + 2S2O32– → 2I– + S4O62–
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, Warszawa 2007.
Rozstrzygnij, czy jony dichromianowe(VI) w etapie pierwszym oraz jod w etapie drugim pełnią taką samą funkcję (utleniacza albo reduktora). Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczanie masy dichromianu(VI) potasu w badanej próbce. Zadanie 19.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Zawartość jonów dichromianowych(VI) w wodnym roztworze można określić dzięki zastosowaniu metody pośredniej. W pierwszym etapie dodaje się roztwór jodku potasu i kwas siarkowy(VI). Zachodzi wtedy reakcja opisana równaniem:
Cr2O72– + 6I– + 14H+ → 2Cr3+ + 3I2 + 7H2O
W drugim etapie do otrzymanej mieszaniny dodaje się roztwór tiosiarczanu sodu i wtedy jony S2O32– reagują z jodem:
I2 + 2S2O32– → 2I– + S4O62–
Na podstawie: D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, Warszawa 2007.
Aby określić zawartość jonów dichromianowych(VI) w próbce, przeprowadzono opisane reakcje. W reakcji z jodem wzięło udział 20,4 cm3 wodnego roztworu tiosiarczanu sodu o stężeniu 0,10 mol∙dm–3.
Oblicz, ile gramów dichromianu(VI) potasu zawierała badana próbka. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100% oraz że masa molowa dichromianu(VI) potasu MK2Cr2O7 = 294 g·mol–1.
Wybór poprawnych określeń dotyczących struktury cząsteczek etanu, etenu oraz etynu. Zadanie 20. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Poniżej przedstawiono wartości energii wiązań chemicznych pomiędzy atomami węgla oraz długości tych wiązań w cząsteczkach etanu, etenu i etynu.
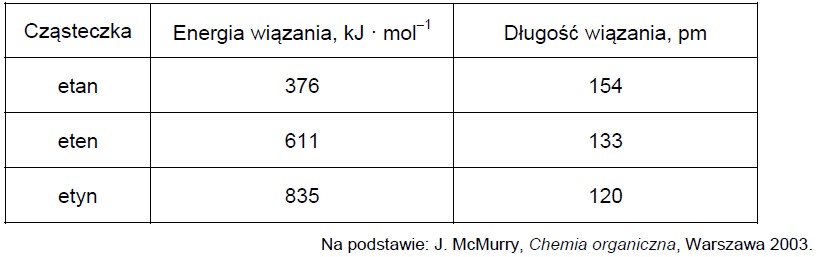
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. 1. W cząsteczce etenu orbitalom walencyjnym atomów węgla przypisuje się hybrydyzację (sp3 / sp2). Podwójne wiązanie węgiel – węgiel w cząsteczce etenu powstaje w wyniku uwspólnienia (dwóch / czterech) elektronów. 2. Cząsteczki etynu są (liniowe / trygonalne). 3. Wraz ze wzrostem długości wiązania (rośnie / maleje) wartość energii niezbędnej do rozerwania wiązania.
Zapis wzoru elektronowego kreskowego produktu reakcji monochlorowania etanu. Zadanie 21. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Jednym z produktów reakcji etanu z chlorem oraz produktem reakcji etenu z chlorowodorem jest ten sam związek organiczny.
Narysuj wzór elektronowy opisanego związku. Zaznacz kreskami wszystkie wspólne i wolne pary elektronowe.

