Zapis równania reakcji jodu z wodnym roztworem zasady. Zadanie 19. Informator CKE chemia 2023 rozszerzony (1 punkt)
Jod bardzo słabo rozpuszcza się w wodzie i jego nasycony roztwór, nazywany wodą jodową, w temperaturze 25 oC ma stężenie ok. 1,3·10–3 mol·dm–3. Dużo lepiej jod rozpuszcza się (roztwarza) w roztworze zawierającym jony jodkowe, gdyż przebiega tam reakcja opisana równaniem:
I2 + I– ⇄ I3–
Stężeniowa stała tej równowagi w temperaturze 25 oC jest równa 700.
W niektórych schorzeniach tarczycy stosuje się tzw. płyn Lugola, który można przyrządzić, jeśli wymiesza się 1 g jodu i 2 g jodku potasu z 97 g wody.
Jon trijodkowy I3– ma budowę liniową.
W roztworze wodnym o odczynie zasadowym cząsteczki jodu ulegają reakcji dysproporcjonowania, w wyniku czego tworzą się jony jodkowe i jony jodanowe(I). Jodany(I) są tak nietrwałe, że łatwo ulegają kolejnej przemianie, której produktami są jodki i jodany(V).
Napisz w formie jonowej sumaryczne równanie reakcji zachodzącej po wprowadzeniu jodu do wodnego roztworu wodorotlenku sodu.
Rysowanie wykresu zależności rozpuszczalności jodku potasu od temperatury. Zadanie 20. Informator CKE chemia 2023 rozszerzony (4 punkty)
W poniższych tabelach zamieszczone są dane dotyczące wodnych roztworów jodku potasu.
Tabela 1. Zależność rozpuszczalności jodku potasu (KI) od temperatury.
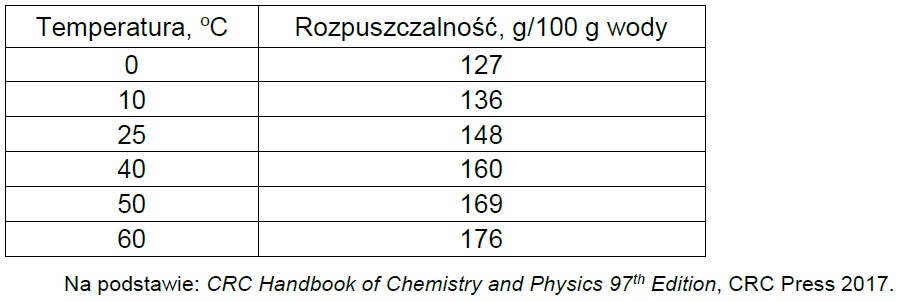
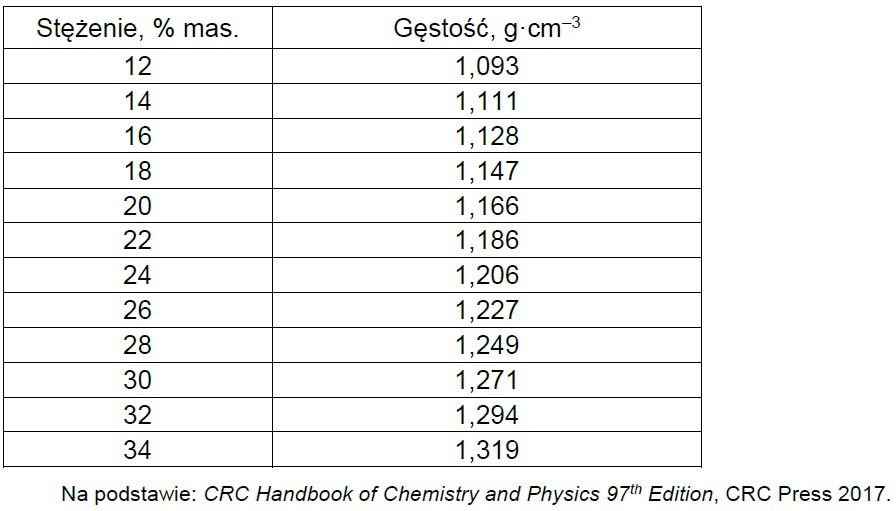
Tabela 2. Zależność gęstości roztworów jodku potasu od stężenia (t = 20 oC)
Przygotowano 100 g wodnego roztworu jodku potasu w temperaturze t = 20 oC, a następnie go rozcieńczono, dodając 195 g wody i utrzymując stałą temperaturę 20 oC.
Na podstawie zamieszczonych informacji narysuj wykres zależności rozpuszczalności jodku potasu od temperatury, a następnie oblicz stężenie molowe roztworu otrzymanego po zmieszaniu 100 g roztworu nasyconego i 195 g wody w temperaturze 20 oC.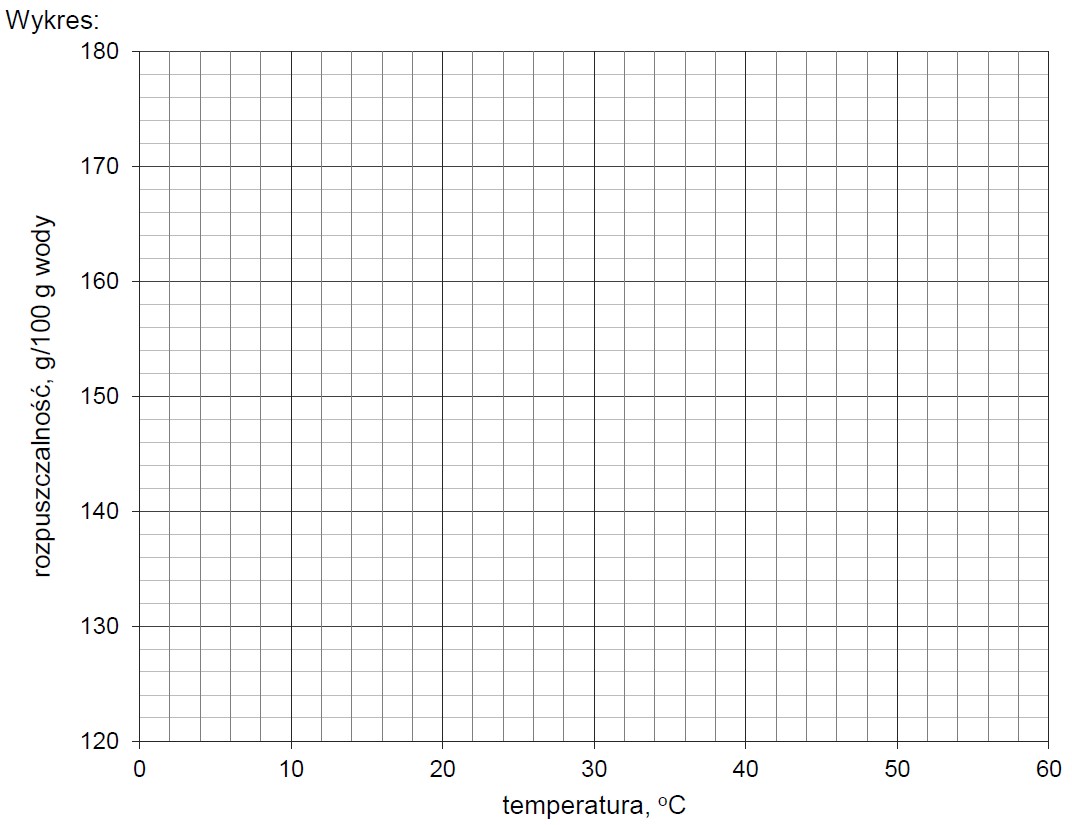
Ustalanie symboli pierwiastków chemicznych w ich tlenkach. Zadanie 21.1. Informator CKE chemia 2023 rozszerzony (2 punkty)
Dwa tlenki metali, oznaczone umownie wzorami A2O i XO3, reagują ze sobą w stosunku molowym 1:1. Produktem reakcji jest jonowy związek Z, w którym masowa zawartość procentowa pierwiastka A wynosi 40,2%, natomiast dla pierwiastka X ta wielkość jest równa 26,8%.
Na podstawie obliczeń ustal symbole pierwiastków A i X.
Wybór fotografii ilustrującej określony związek chemiczny. Zadanie 21.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Dwa tlenki metali, oznaczone umownie wzorami A2O i XO3, reagują ze sobą w stosunku molowym 1:1. Produktem reakcji jest jonowy związek Z, w którym masowa zawartość procentowa pierwiastka A wynosi 40,2%, natomiast dla pierwiastka X ta wielkość jest równa 26,8%.
Zaznacz numer zdjęcia, na którym przedstawiono związek Z.
Przypisanie roztworów do odpowiednich naczyń na podstawie wyglądu na fotografii. Zadanie 22.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
W dwóch kolbach znajdują się dwa różne, ale podobnie wyglądające roztwory wodne:

Spośród wymienionych niżej roztworów wybierz te, które mogą wyglądać tak jak roztwory pokazane na ilustracjach. Zaznacz ich wzory lub nazwy.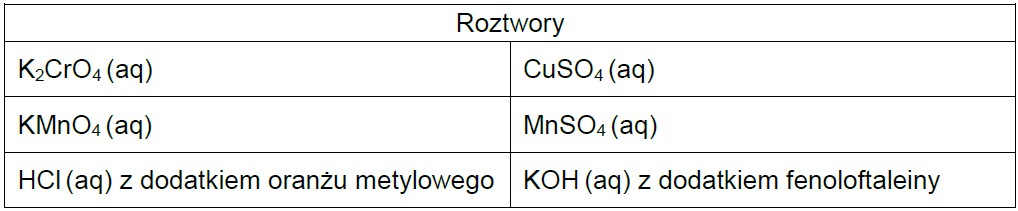
Wybór odczynników, które mają wywołać zmianę barw roztworów. Zadanie 22.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
W dwóch kolbach znajdują się dwa różne, ale podobnie wyglądające roztwory wodne:

Przeprowadzono dwa niezależne doświadczenia, w których do roztworów z obu naczyń dodano jeden taki sam odczynnik. W każdym z tych doświadczeń nastąpiła wyraźna zmiana barwy tylko jednego roztworu.
Wybierz dwa odczynniki, z których każdy po dodaniu (w odpowiedniej ilości) do obu badanych roztworów spowoduje wyraźną zmianę barwy tylko jednego z nich. Zaznacz wzory wybranych odczynników.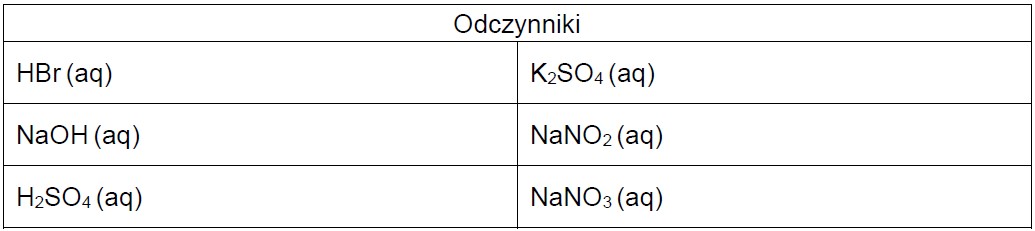
Zapis równań reakcji chemicznych z udziałem wybranych odczynników. Zadanie 22.3. Informator CKE chemia 2023 rozszerzony (1 punkt)
W dwóch kolbach znajdują się dwa różne, ale podobnie wyglądające roztwory wodne:

Przeprowadzono dwa niezależne doświadczenia, w których do roztworów z obu naczyń dodano jeden taki sam odczynnik. W każdym z tych doświadczeń nastąpiła wyraźna zmiana barwy tylko jednego roztworu.
Napisz w formie jonowej skróconej równania reakcji, których przebieg był przyczyną zmiany barwy roztworu z każdego naczynia.
Wskazanie ucznia, który poprawnie wykonał doświadczenie. Zadanie 23. Informator CKE chemia 2023 rozszerzony (2 punkty)
Uczniowie wykonywali doświadczenie, podczas którego działali kwasem solnym na węglan wapnia, w zestawie umożliwiającym pochłanianie wydzielającego się CO2 w roztworze KOH. Naczynie z tym roztworem miało być zważone przed doświadczeniem i po jego zakończeniu. Reakcje wydzielania i pochłaniania CO2 opisują równania:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO2 + 2KOH → K2CO3 + H2O
Węglan wapnia był stosowany w nadmiarze, natomiast kwas solny miał nieznane stężenie, ale mógł zostać dokładnie odmierzony. Na podstawie jego objętości oraz przyrostu masy naczynia z KOH, uczniowie mieli oszacować stężenie roztworu HCl. Swoje pomiary zapisali w poniższej tabeli: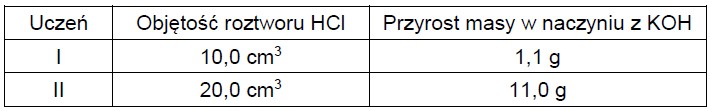
Okazało się, że jeden z uczniów błędnie zmierzył lub błędnie zapisał przyrost masy.
Oblicz stężenie molowe badanego roztworu na podstawie wyników ucznia I i ucznia II. Wskaż ucznia, który poprawnie wykonał doświadczenie. Odpowiedź uzasadnij. Doświadczenie poprawnie wykonał uczeń: Uzasadnienie:
Uszeregowanie związków chemicznych według wzrastającego stężenia jonów wodorotlenkowych w ich roztworach. Zadanie 26.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
NaCl CH3COOH Ba(OH)2 NaNO2 HBr
Uszereguj związki o podanych wzorach zgodnie ze wzrastającym stężeniem jonów OH– ich wodnych roztworów. Napisz wzory tych związków w odpowiedniej kolejności.
Wybór roztworów w których oranż metylowy zabarwi się na kolor czerwony. Zadanie 26.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przygotowano wodne roztwory pięciu substancji chemicznych o podanych niżej wzorach. Wszystkie roztwory miały takie samo stężenie molowe 0,1 mol·dm–3.
NaCl CH3COOH Ba(OH)2 NaNO2 HBr
Napisz wzory tych związków, których wodne roztwory po dodaniu do nich wodnego roztworu oranżu metylowego zabarwią się na czerwono.
Obliczanie pH roztworu stanowiącego mieszaninę roztworów dwóch słabych kwasów. Zadanie 27. Informator CKE chemia 2023 rozszerzony (2 punkty)
W praktyce analitycznej stosuje się roztwory zawierające mieszaninę dwóch kwasów lub zasad. Jeżeli roztwór zawiera mieszaninę dwóch słabych kwasów jednoprotonowych, można przyjąć z pewnym przybliżeniem, że stężenie jonów hydroniowych w tym roztworze jest równe:
![]()
gdzie:
KaI i KaII – stałe dysocjacji kwasów
cI i cII – stężenia kwasów w otrzymanej mieszaninie.
Na podstawie: A. Hulanicki, Reakcje kwasów i zasad w chemii analitycznej, Warszawa 1992.
W temperaturze T zmieszano 50,0 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 0,10 mol · dm–3 z 50,0 cm3 wodnego roztworu kwasu etanowego (octowego) o stężeniu 0,10 mol · dm–3. W temperaturze T stała dysocjacji kwasu metanowego jest równa 1,77 · 10–4, a stała dysocjacji kwasu etanowego wynosi 1,75 · 10–5.
Na podstawie: R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1985.
Oblicz pH otrzymanego roztworu. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości roztworów wyjściowych. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.