Wskazanie położenia pierwiastka w układzie okresowym. Zadanie 1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Elektrony atomu pierwiastka X w stanie podstawowym zajmują siedem orbitali, przy czym sześć z nich jest całkowicie zapełnionych. Ten pierwiastek reaguje zarówno z kwasem solnym, jak i ze stężonym wodnym roztworem wodorotlenku potasu. Jednym z produktów obu przemian jest ten sam gaz.
Uzupełnij poniższą tabelę – wpisz dane dotyczące położenia pierwiastka X w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego ten pierwiastek należy.
Ocena poprawności zdań dotyczących liczb kwantowych. Zadanie 2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Elektrony atomu pierwiastka X w stanie podstawowym zajmują siedem orbitali, przy czym sześć z nich jest całkowicie zapełnionych. Ten pierwiastek reaguje zarówno z kwasem solnym, jak i ze stężonym wodnym roztworem wodorotlenku potasu. Jednym z produktów obu przemian jest ten sam gaz.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. W stanie podstawowym tylko 6 elektronów atomu pierwiastka X jest opisanych główną liczbą kwantową 𝑛 równą 2.
2. Żaden elektron atomu pierwiastka X w stanie podstawowym nie jest opisany poboczną liczbą kwantową 𝑙 równą 2.
Zapis równań reakcji chemicznych z udziałem odszyfrowanego pierwiastka. Zadanie 3. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Elektrony atomu pierwiastka X w stanie podstawowym zajmują siedem orbitali, przy czym sześć z nich jest całkowicie zapełnionych. Ten pierwiastek reaguje zarówno z kwasem solnym, jak i ze stężonym wodnym roztworem wodorotlenku potasu. Jednym z produktów obu przemian jest ten sam gaz.
Napisz w formie jonowej skróconej równania reakcji pierwiastka X: Równanie reakcji 1.: Równanie reakcji 2.:
– z kwasem solnym (reakcja 1.)
oraz
– ze stężonym roztworem wodorotlenku potasu (reakcja 2.).
W reakcji 2. powstaje jon kompleksowy o liczbie koordynacji równej 4.
Wskazanie konfiguracji elektronowej odpowiadającej stanowi wzbudzonemu. Zadanie 4. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Poniżej przedstawiono konfigurację elektronową atomów czterech pierwiastków (I – IV):
I 1s22s22p63s23p64s1
II 1s22s22p63s23p64s13d5
III 1s22s22p63s23p64s13d104p3
IV 1s22s22p63s23p64s13d10
Napisz, która z przedstawianych konfiguracji elektronowych opisuje atom w stanie wzbudzonym. Odpowiedź uzasadnij. Konfiguracja: Uzasadnienie:
Zapis równania reakcji jądrowej powstawania izotopu tenesu. Zadanie 5. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Tenes – pierwiastek chemiczny o liczbie atomowej Z = 117 – otrzymano w reakcji jądrowej między 48Ca i 249Bk. W tym procesie powstały dwa izotopy tenesu, przy czym reakcji tworzenia jądra jednego z tych izotopów towarzyszyła emisja 3 neutronów. Ten izotop ulegał dalszym przemianom: w wyniku kilku kolejnych przemian α otrzymano dubn – 270Db.
Napisz równanie reakcji otrzymywania opisanego izotopu tenesu – uzupełnij wszystkie pola w poniższym schemacie. Napisz, w wyniku ilu przemian 𝛂 ten izotop tenesu przekształcił się w 270Db. Otrzymywanie izotopu tenesu: Liczba przemian α: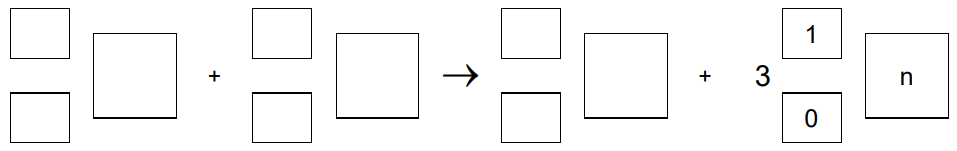
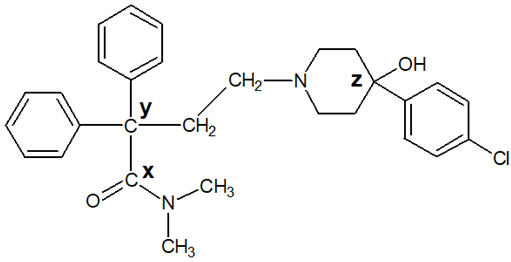
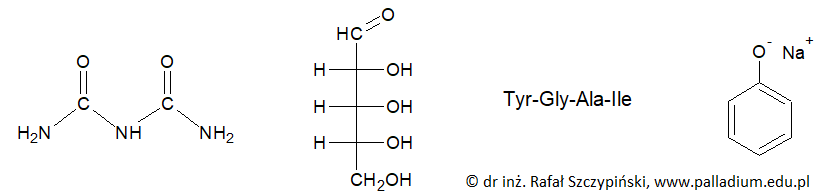
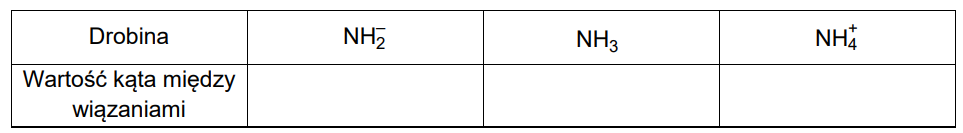
Określanie kształtów cząsteczek z zastosowaniem metody VSEPR. Zadanie 6.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Metoda VSEPR pozwala określać kształt cząsteczek zbudowanych z atomów pierwiastków grup głównych. W cząsteczce należy wyróżnić atom centralny (np. atom tlenu w cząsteczce H2O) i ustalić liczbę wolnych par elektronowych na jego zewnętrznej powłoce. Następnie zsumować liczbę podstawników związanych z atomem centralnym (𝑥) i liczbę jego wolnych par elektronowych (𝑦). W ten sposób otrzymuje się tzw. liczbę przestrzenną (𝐿p = 𝑥 + 𝑦), która determinuje kształt cząsteczki. Ponieważ zarówno wolne, jak i wiążące pary elektronowe wzajemnie się odpychają, wszystkie elementy składające się na liczbę przestrzenną (podstawniki i wolne pary elektronowe) zajmują jak najbardziej odległe od siebie położenia wokół atomu centralnego.
Na podstawie: R. J. Gillespie, Fifty years of the VSEPR model; Coordination Chemistry Reviews 252 (2008) 1315.
Uzupełnij poniższą tabelę – dla wymienionych cząsteczek napisz wartości 𝒙 i 𝒚 oraz określ kształt cząsteczki (liniowa, kątowa, trójkątna, tetraedryczna).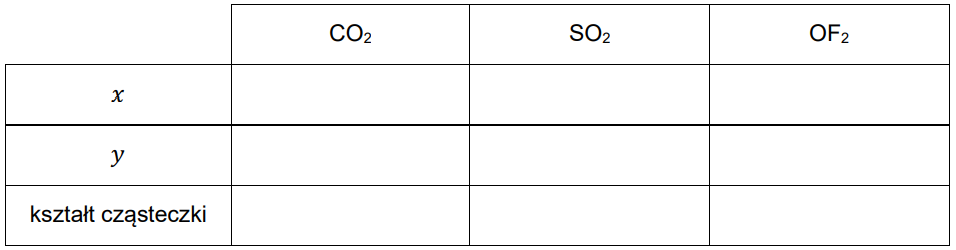
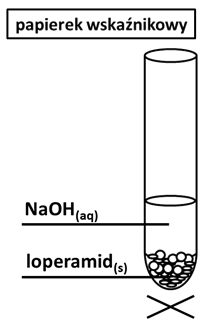
Wskazanie modelu odpowiadającego kształtem cząsteczce tetrafluorku siarki. Zadanie 6.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Metoda VSEPR pozwala określać kształt cząsteczek zbudowanych z atomów pierwiastków grup głównych. W cząsteczce należy wyróżnić atom centralny (np. atom tlenu w cząsteczce H2O) i ustalić liczbę wolnych par elektronowych na jego zewnętrznej powłoce. Następnie zsumować liczbę podstawników związanych z atomem centralnym (𝑥) i liczbę jego wolnych par elektronowych (𝑦). W ten sposób otrzymuje się tzw. liczbę przestrzenną (𝐿p = 𝑥 + 𝑦), która determinuje kształt cząsteczki. Ponieważ zarówno wolne, jak i wiążące pary elektronowe wzajemnie się odpychają, wszystkie elementy składające się na liczbę przestrzenną (podstawniki i wolne pary elektronowe) zajmują jak najbardziej odległe od siebie położenia wokół atomu centralnego.
Na podstawie: R. J. Gillespie, Fifty years of the VSEPR model; Coordination Chemistry Reviews 252 (2008) 1315.
Poniżej przedstawiono dwa modele przestrzenne (I i II) różnych cząsteczek o wzorze ogólnym AB4.
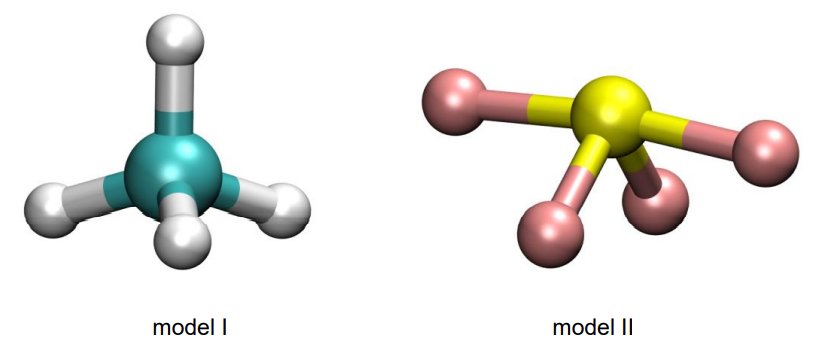
Rozstrzygnij, który z przedstawionych modeli (I albo II) jest ilustracją kształtu cząsteczki SF4. Uzasadnij swój wybór. Zastosuj metodę VSEPR. Cząsteczkę SF4 przedstawia model Uzasadnienie: