Wskazanie pierwiastków spełniających określone warunki. Zadanie 7. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Na podstawie budowy atomów pierwiastków należących do grup 1.–2. oraz 13.–17. drugiego okresu układu okresowego uzupełnij poniższe zdanie. W wyznaczone miejsca wpisz symbol albo nazwę odpowiedniego pierwiastka.
Spośród pierwiastków drugiego okresu: • najmniejszy ładunek jądra ma atom: • najmniejszy promień atomowy ma atom: • najmniejszą wartość pierwszej energii jonizacji ma atom:
Opis zmian dotyczących przeprowadzonego doświadczenia z udziałem wody mineralnej. Zadanie 8.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
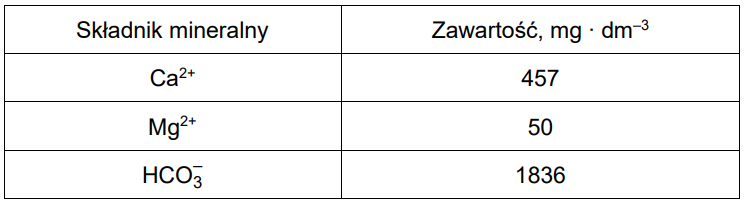
W pewnej wodzie mineralnej znajdują się jony: Ca2+, Mg2+ oraz HCO3–. Ich zawartość przedstawiono w poniższej tabeli.
Przeprowadzono doświadczenie zilustrowane na poniższym schemacie:
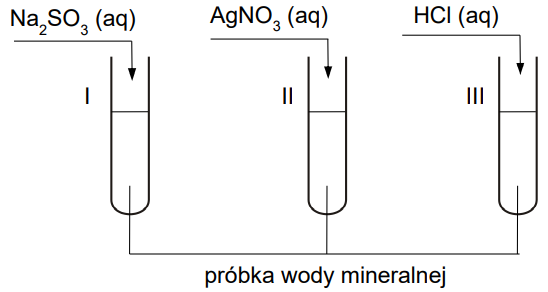
W wyniku przeprowadzonego doświadczenia w każdej probówce zaobserwowano zmianę świadczącą o zajściu reakcji chemicznej. W probówce II, w wyniku przeprowadzonego doświadczenia, wydzielił się biały osad.
Opisz zmiany, które można zaobserwować w probówkach I i III. Probówka I: Probówka III:
Opis zmian dotyczących przeprowadzonego doświadczenia z udziałem wody mineralnej. Zadanie 8.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
W pewnej wodzie mineralnej znajdują się jony: Ca2+, Mg2+ oraz HCO3–. Ich zawartość przedstawiono w poniższej tabeli.

Przeprowadzono doświadczenie zilustrowane na poniższym schemacie:

W wyniku przeprowadzonego doświadczenia w każdej probówce zaobserwowano zmianę świadczącą o zajściu reakcji chemicznej. W probówce II, w wyniku przeprowadzonego doświadczenia, wydzielił się biały osad.
Rozstrzygnij, czy na podstawie przeprowadzonego doświadczenia można stwierdzić, że w badanej wodzie mineralnej są obecne też inne jony niż Ca2+, Mg2+ oraz HCO3–. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Obliczanie procentu wagowego węglanu magnezu w osadzie. Zadanie 9. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
W pewnej wodzie mineralnej znajdują się jony: Ca2+, Mg2+ oraz HCO3–. Ich zawartość przedstawiono w poniższej tabeli.

Podczas gotowania 1000 cm3 tej wody mineralnej zaobserwowano powstanie białego osadu. W opisanych warunkach przebiegły reakcje opisane równaniami:
Ca2+ + 2HCO3– → CaCO3 + CO2 + H2O
Mg2+ + 2HCO3– → MgCO3 + CO2 + H2O
Oblicz, jaki procent masy wydzielonego osadu stanowi masa węglanu magnezu. Przyjmij, że obie reakcje zachodzą z wydajnością równą 100%, a powstały osad składa się wyłącznie z węglanu wapnia i węglanu magnezu.
Uzasadnienie odczynu roztworu soli Mohra równaniem reakcji. Zadanie 10. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Sól Mohra to zwyczajowa nazwa siarczanu(VI) żelaza(II) i amonu o wzorze (NH4)2Fe(SO4)2. W laboratorium chemicznym ten związek jest często używany jako wygodne i stabilne źródło jonów żelaza(II). Zarówno sama sól Mohra, jak i jej wodne roztwory są odporne na utlenianie na powietrzu.
Obecność jonów amonowych w roztworze soli Mohra powoduje, że odczyn tego roztworu nie jest obojętny.
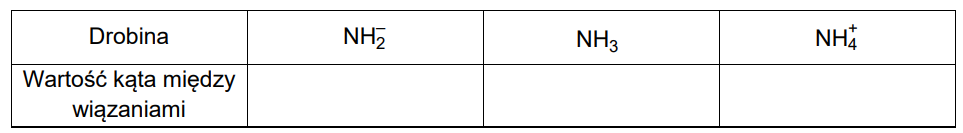
Napisz równanie reakcji odpowiadającej za odczyn wodnego roztworu soli Mohra na podstawie definicji kwasów i zasad Brønsteda. Wzory odpowiednich drobin wpisz w poniższą tabelę.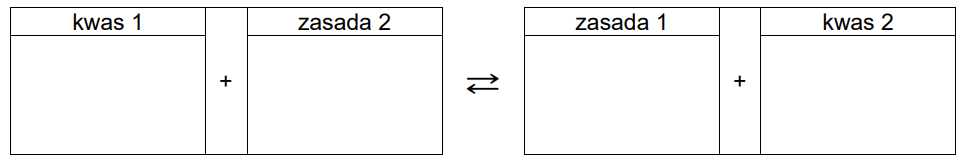
Zapis równania reakcji chemicznej prowadzącej do powstania substancji barwiącej papierek wskaźnikowy. Zadanie 11.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Sól Mohra to zwyczajowa nazwa siarczanu(VI) żelaza(II) i amonu o wzorze (NH4)2Fe(SO4)2. W laboratorium chemicznym ten związek jest często używany jako wygodne i stabilne źródło jonów żelaza(II). Zarówno sama sól Mohra, jak i jej wodne roztwory są odporne na utlenianie na powietrzu.
Przeprowadzono dwuetapowe doświadczenie. W pierwszym etapie do dwóch probówek (A i B) z roztworem soli Mohra dodano wodny roztwór wodorotlenku sodu. Wynik doświadczenia w obu probówkach był identyczny i został przedstawiony na fotografii.

W czasie doświadczenia zaszła reakcja chemiczna opisana równaniem:
Fe2+ + 2OH– → Fe(OH)2
Zaobserwowano również, że zwilżony uniwersalny papierek wskaźnikowy umieszczony u wylotu probówki zabarwił się na niebiesko.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej po dodaniu wodnego roztworu wodorotlenku sodu, w wyniku której powstała substancja odpowiedzialna za zmianę barwy uniwersalnego papierka wskaźnikowego.
Zapis równania reakcji chemicznej jaka przebiegła w probówce. Zadanie 11.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Sól Mohra to zwyczajowa nazwa siarczanu(VI) żelaza(II) i amonu o wzorze (NH4)2Fe(SO4)2. W laboratorium chemicznym ten związek jest często używany jako wygodne i stabilne źródło jonów żelaza(II). Zarówno sama sól Mohra, jak i jej wodne roztwory są odporne na utlenianie na powietrzu.
Przeprowadzono dwuetapowe doświadczenie. W pierwszym etapie do dwóch probówek (A i B) z roztworem soli Mohra dodano wodny roztwór wodorotlenku sodu. Wynik doświadczenia w obu probówkach był identyczny i został przedstawiony na fotografii.

W czasie doświadczenia zaszła reakcja chemiczna opisana równaniem:
Fe2+ + 2OH– → Fe(OH)2
Zaobserwowano również, że zwilżony uniwersalny papierek wskaźnikowy umieszczony u wylotu probówki zabarwił się na niebiesko.
W drugim etapie doświadczenia do zawartości probówki A otrzymanej w poprzednim etapie dodano wodę utlenioną, czyli roztwór nadtlenku wodoru o stężeniu 3 %. Wynik tej części doświadczenia przedstawiono na fotografii.

Napisz w formie cząsteczkowej równanie reakcji zachodzącej w probówce A.
Wyjaśnienie przyczyny zmian w otwartej probówce pozostawionej na powietrzu. Zadanie 11.3. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Sól Mohra to zwyczajowa nazwa siarczanu(VI) żelaza(II) i amonu o wzorze (NH4)2Fe(SO4)2. W laboratorium chemicznym ten związek jest często używany jako wygodne i stabilne źródło jonów żelaza(II). Zarówno sama sól Mohra, jak i jej wodne roztwory są odporne na utlenianie na powietrzu.
Przeprowadzono dwuetapowe doświadczenie. W pierwszym etapie do dwóch probówek (A i B) z roztworem soli Mohra dodano wodny roztwór wodorotlenku sodu. Wynik doświadczenia w obu probówkach był identyczny i został przedstawiony na fotografii.

W czasie doświadczenia zaszła reakcja chemiczna opisana równaniem:
Fe2+ + 2OH– → Fe(OH)2
Zaobserwowano również, że zwilżony uniwersalny papierek wskaźnikowy umieszczony u wylotu probówki zabarwił się na niebiesko.
Probówkę B pozostawiono przez dłuższy czas na powietrzu. W probówce zaobserwowano zmiany, które zilustrowano na poniższych fotografiach.

Wyjaśnij przyczyny obserwowanych zmian w probówce B pomimo niedodania do tej probówki żadnego odczynnika. Wyjaśnienie:
Wskazanie ucznia, który właściwie zaprojektował doświadczenie chemiczne. Zadanie 12. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Gazowy wodór wydziela się w reakcjach różnych metali z kwasami, a najaktywniejsze metale redukują wodę do wodoru. Na zajęciach koła chemicznego uczniowie mieli zaprojektować laboratoryjną metodę otrzymywania wodoru, inną niż stosowane powszechnie działanie kwasem solnym na cynk.
Zaproponowano przeprowadzenie następujących reakcji:
uczeń A – magnezu z kwasem octowym;
uczeń B – potasu z wodą;
uczeń C – cynku ze stężonym kwasem azotowym(V).
Nauczyciel stwierdził, że wodór powstaje w dwóch spośród zaproponowanych reakcji, ale tylko jedna z nich jest możliwa do przeprowadzenia w szkolnej pracowni chemicznej.
Napisz, który uczeń poprawnie zaprojektował doświadczenie. Wyjaśnij, dlaczego druga propozycja doświadczenia, w którym również powstaje wodór, była nieodpowiednia. Odwołaj się do zasad bezpieczeństwa i higieny pracy obowiązujących w szkolnej pracowni chemicznej. Doświadczenie poprawnie zaprojektował uczeń: Wyjaśnienie:
Obliczanie objętości dodanego roztworu NaOH. Zadanie 13. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Do zlewki wprowadzono 80 cm3 roztworu mocnego (całkowicie zdysocjowanego), jednoprotonowego kwasu HA o stężeniu 0,10 mol · dm–3. Następnie do zlewki wprowadzono 45 cm3 roztworu wodorotlenku potasu o stężeniu 0,15 mol · dm–3. Do takiej mieszaniny dodawano kroplami roztwór wodorotlenku sodu o stężeniu 0,2 mol · dm–3 do momentu uzyskania roztworu o pH równym 2,1.
Oblicz objętość dodanego roztworu wodorotlenku sodu. Przyjmij, że objętość mieszaniny była sumą objętości zmieszanych roztworów.
Obliczanie stałej równowagi reakcji. Zadanie 14. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (4 punkty)
Do reaktora wprowadzono próbkę N2O4 o masie równej 4,14 g. W reaktorze utrzymywano stałe ciśnienie równe 1000 hPa i stałą temperaturę 298 K, natomiast zmianie mogła ulegać pojemność. W warunkach prowadzenia eksperymentu ustaliła się równowaga chemiczna opisana równaniem:
N2O4 ⇄ 2NO2
Objętość mieszaniny obu tlenków, po ustaleniu się stanu równowagi, była równa 1,32 dm3.
Oblicz stężeniową stałą równowagi Kc przemiany w opisanych warunkach. Stała gazowa R = 83,14 hPa · dm3 · mol–1 · K–1. Przyjmij, że NO2 i N2O4 są gazami doskonałymi.
Zapis jednostki stałej szybkości reakcji chemicznej. Zadanie 15.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Równanie kinetyczne reakcji opisanej równaniem:
2NO (g) + O2 (g) → 2NO2 (g)
ma postać:

Szybkość reakcji chemicznej v, wyrażona w jednostce: mol · dm−3 · s−1 , zależy od stężeń molowych substratów reakcji oraz od stałej szybkości reakcji 𝑘 – współczynnika charakterystycznego dla danej reakcji. Stała szybkości reakcji zależy od temperatury, a nie zależy od stężenia substratów.
Napisz jednostkę stałej szybkości reakcji 𝒌 w równaniu kinetycznym opisanej reakcji.
Obliczanie ile razy zmaleje szybkość reakcji chemicznej. Zadanie 15.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Równanie kinetyczne reakcji opisanej równaniem:
2NO (g) + O2 (g) → 2NO2 (g)
ma postać:

W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole tlenu. Podczas reakcji utrzymywano stałą temperaturę T.
Oblicz, ile razy zmaleje szybkość opisanej reakcji w stosunku do szybkości początkowej, w momencie, w którym stężenie tlenu zmniejszy się o 1 mol · dm−3.
Zapis wzorów sumarycznych jonów kompleksowych miedzi(II). Zadanie 16. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Jony miedzi(II) tworzą wiele różnych związków kompleksowych. W roztworze wodnym nie występują w postaci prostych kationów Cu2+, lecz jako jony uwodnione, czyli akwakompleksy. W akwakompleksie jon miedzi(II) przyjmuje liczbę koordynacyjną równą 6. Ten kompleks jest mniej trwały niż kompleks miedzi(II) z amoniakiem, dlatego w obecności amoniaku o odpowiednim stężeniu w roztworze związku miedzi(II) tworzy się aminakompleks, w którym liczba koordynacyjna jonu Cu2+ także jest równa 6, ale cztery cząsteczki wody są zastąpione czterema cząsteczkami amoniaku. Nosi on nazwę jonu diakwatetraaminamiedzi(II). Obecność tych jonów nadaje roztworowi ciemnoniebieską barwę. Roztwory, w których obecne są opisane jony kompleksowe, przedstawiono na poniższych fotografiach.

Napisz wzory opisanych jonów kompleksowych: akwakompleksu miedzi(II) oraz jonu diakwatetraaminamiedzi(II). Wzór akwakompleksu miedzi(II): Wzór jonu diakwatetraaminamiedzi(II):