Rysowanie kreskowego wzoru elektronowego chlorku boru. Zadanie 3.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Narysuj wzór elektronowy chlorku boru. Uwzględnij wolne pary elektronowe.
Wybór wzorów drobin mogących łączyć się z chlorkiem boru oraz uzasadnienie wyboru. Zadanie 3.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych drobin: Cl– NH4+ CH4 NH3 wybierz te, które mogą łączyć się z chlorkiem boru, i napisz ich wzory. Wyjaśnij, dlaczego cząsteczki chlorku boru mają zdolność do tworzenia wiązań z tymi drobinami. Odwołaj się do struktury elektronowej cząsteczek chlorku boru. Z chlorkiem boru mogą łączyć się: Cząsteczki chlorku boru mają zdolność do tworzenia wiązań z wybranymi drobinami, ponieważ
Zapis równania reakcji chlorku boru z wodą. Zadanie 3.3. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Bor tworzy z chlorem związek o wzorze BCl3, występujący w postaci płaskich trójkątnych cząsteczek. Te cząsteczki mogą łączyć się z innymi drobinami zawierającymi wolne pary elektronowe. Chlorek boru reaguje z wodą i podczas tej reakcji tworzą się H3BO3 (kwas ortoborowy) oraz HCl.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Napisz w formie cząsteczkowej równanie reakcji chlorku boru z wodą.
Wybór numeru reakcji wraz z uzasadnieniem na podstawie wykresu przedstawiającego zależność stopnia przemiany od temperatury. Zadanie 4.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Gaz syntezowy, czyli mieszanina CO i H2, jest otrzymywany w przemyśle różnymi metodami. Niżej podano równania dwóch reakcji, w których powstaje taka mieszanina.
I CH4 + CO2 → 2CO + 2H2 ∆H < 0
II CH4 + H2O → CO + 3H2 ∆H > 0
Na poniższym wykresie przedstawiono zależność stopnia przemiany metanu od temperatury dla dwóch różnych wartości ciśnienia dla jednej z tych reakcji. Stopień przemiany metanu jest miarą wydajności reakcji – im większy stopień przemiany, tym większa wydajność reakcji.
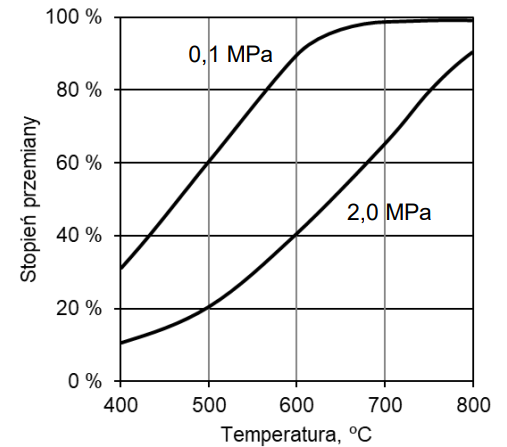
Na podstawie: M. Pańczyk, T. Borowiecki, Otrzymywanie i zastosowanie gazu syntezowego, Lublin 2013.
Napisz numer reakcji (I albo II), do której odnosi się powyższy wykres stopnia przemiany metanu. Odpowiedź uzasadnij – uwzględnij efekt energetyczny reakcji. Numer reakcji: Uzasadnienie:
Określenie wpływu ciśnienia na stopień przemiany metanu. Zadanie 4.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Gaz syntezowy, czyli mieszanina CO i H2, jest otrzymywany w przemyśle różnymi metodami. Niżej podano równania dwóch reakcji, w których powstaje taka mieszanina.
I CH4 + CO2 → 2CO + 2H2 ∆H < 0
II CH4 + H2O → CO + 3H2 ∆H > 0
Na poniższym wykresie przedstawiono zależność stopnia przemiany metanu od temperatury dla dwóch różnych wartości ciśnienia dla jednej z tych reakcji. Stopień przemiany metanu jest miarą wydajności reakcji – im większy stopień przemiany, tym większa wydajność reakcji.

Na podstawie: M. Pańczyk, T. Borowiecki, Otrzymywanie i zastosowanie gazu syntezowego, Lublin 2013.
Uzupełnij zdanie o wpływie ciśnienia na stopień przemiany metanu – wybierz i zaznacz jedną odpowiedź spośród podanych w nawiasie. Wyjaśnij przedstawioną na wykresie zależność stopnia przemiany metanu od ciśnienia. W stałej temperaturze wzrost ciśnienia skutkuje (wzrostem / spadkiem) stopnia przemiany metanu. Wyjaśnienie:
Obliczanie procentu objętościowego substratu w mieszaninie użytej do reakcji. Zadanie 5. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Do reaktora o pojemności 1,0 dm3 wprowadzono pewną liczbę moli substancji A oraz pewną liczbę moli substancji B. Reaktor zamknięto i zainicjowano reakcję chemiczną, która przebiegała w stałej temperaturze T zgodnie z równaniem:
A (g) + B (g) ⇄ C (g) + D (g)
Do momentu ustalenia stanu równowagi przereagowało 20% substancji A. W tych warunkach stężeniowa stała równowagi opisanej reakcji jest równa 2,0.
Oblicz, jaki procent liczby moli wyjściowej mieszaniny stanowiła substancja A.
Zapis wzorów anionów nadtlenkowego oraz tlenkowego. Zadanie 6.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Produktem spalania metalicznego sodu w tlenie jest nadtlenek sodu o wzorze Na2O2. W wyniku reakcji tego związku z sodem w podwyższonej temperaturze można otrzymać tlenek sodu Na2O. Każdy z opisanych związków sodu z tlenem ma budowę jonową i tworzy sieć krystaliczną zbudowaną z kationów i anionów. Nadtlenek sodu reaguje gwałtownie z wodą. Jednym z produktów tej reakcji, zachodzącej bez zmiany stopni utlenienia, jest nadtlenek wodoru H2O2.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2006.
Napisz wzór anionu występującego w nadtlenku sodu oraz wzór anionu występującego w tlenku sodu. Wzór anionu w nadtlenku sodu: Wzór anionu w tlenku sodu:
Zapis równania reakcji nadtlenku sodu z wodą. Zadanie 6.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Produktem spalania metalicznego sodu w tlenie jest nadtlenek sodu o wzorze Na2O2. W wyniku reakcji tego związku z sodem w podwyższonej temperaturze można otrzymać tlenek sodu Na2O. Każdy z opisanych związków sodu z tlenem ma budowę jonową i tworzy sieć krystaliczną zbudowaną z kationów i anionów. Nadtlenek sodu reaguje gwałtownie z wodą. Jednym z produktów tej reakcji, zachodzącej bez zmiany stopni utlenienia, jest nadtlenek wodoru H2O2.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2006.
Napisz w formie cząsteczkowej równanie reakcji nadtlenku sodu z wodą.
Zapis równania reakcji przebiegającej po zmieszaniu wodnych roztworów jodku potasu i siarczanu(VI) miedzi(II). Zadanie 7. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane schematem.
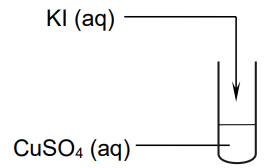
Po zmieszaniu obu roztworów zaszła reakcja utleniania i redukcji, w wyniku której wytrącił się biały osad jodku miedzi(I) i wydzielił się wolny jod.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła po zmieszaniu roztworów KI i CuSO4.
Rozstrzygnięcie wraz z uzasadnieniem, czy kwas solny przereaguje z miedzią. Zadanie 8.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat przedstawia przemiany, jakim ulegają miedź i jej związki.
![]()
Rozstrzygnij, czy substancją A może być kwas solny o stężeniu 10 % masowych. Uzasadnij swoją odpowiedź. W uzasadnieniu odwołaj się do właściwości miedzi i kwasu solnego. Rozstrzygnięcie: Uzasadnienie:
Zapis wzoru wybranej substancji chemicznej oraz równania reakcji. Zadanie 8.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat przedstawia przemiany, jakim ulegają miedź i jej związki.
![]()
Napisz wzór sumaryczny substancji B, jeśli wiadomo, że po zajściu reakcji i odsączeniu osadu w roztworze obecne były kationy sodu i aniony chlorkowe. Napisz w formie jonowej równanie reakcji 3., której produktem jest m.in. jon kompleksowy o wzorze [Cu(NH3)4]2+. Wzór substancji B: Równanie reakcji 3.:
Wybór związków chemicznych roztwarzających wodorotlenek miedzi(II). Zadanie 8.3. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat przedstawia przemiany, jakim ulegają miedź i jej związki.
![]()
Spośród podanych poniżej wzorów wybierz wzory wszystkich substancji, w których wodnych roztworach na zimno roztwarza się wodorotlenek miedzi(II). Napisz numery wybranych wzorów. Wybrane wzory: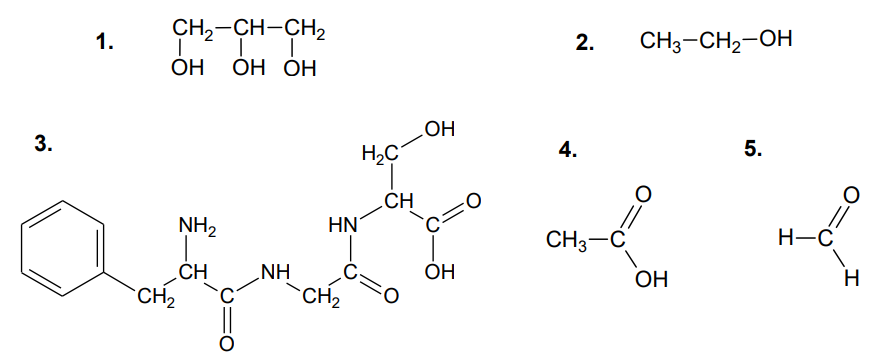
Zapis równania reakcji chemicznej w formie jonowej skróconej oraz wybór właściwej probówki. Zadanie 9.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W dwóch probówkach oznaczonych numerami I i II umieszczono jednakową ilość wiórków magnezowych o tym samym stopniu rozdrobnienia. Następnie do probówek wprowadzono jednakowe objętości roztworów o tej samej temperaturze:
– do probówki I – kwas solny o pH = 1
– do probówki II – wodny roztwór kwasu siarkowego(VI) o stężeniu 0,1 mol·dm–3 .
Przebieg doświadczenia zilustrowano poniższym rysunkiem.
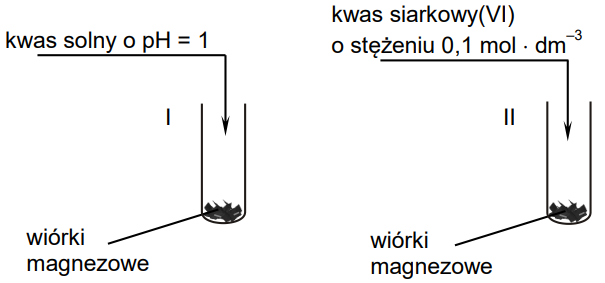
Podczas opisanego doświadczenia w każdej probówce wiórki magnezowe uległy całkowitemu roztworzeniu i powstały klarowne, bezbarwne roztwory, ale w jednej z probówek reakcja przebiegła szybciej.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas opisanego doświadczenia w obu probówkach. Wskaż numer probówki (I albo II), w której wiórki magnezowe roztworzyły się szybciej. Równanie reakcji: Wiórki magnezowe roztworzyły się szybciej w probówce numer
Wybór właściwych określeń dotyczących przebiegu doświadczenia chemicznego. Zadanie 9.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W dwóch probówkach oznaczonych numerami I i II umieszczono jednakową ilość wiórków magnezowych o tym samym stopniu rozdrobnienia. Następnie do probówek wprowadzono jednakowe objętości roztworów o tej samej temperaturze:
– do probówki I – kwas solny o pH = 1
– do probówki II – wodny roztwór kwasu siarkowego(VI) o stężeniu 0,1 mol·dm–3 .
Przebieg doświadczenia zilustrowano poniższym rysunkiem.

Podczas opisanego doświadczenia w każdej probówce wiórki magnezowe uległy całkowitemu roztworzeniu i powstały klarowne, bezbarwne roztwory, ale w jednej z probówek reakcja przebiegła szybciej.
Uzupełnij poniższe zdanie – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Stężenie molowe roztworów obu kwasów było (równe / różne), a stężenie jonów H+ w tych roztworach było (równe / różne), dlatego opisane doświadczenie pozwoliło określić wpływ (stężenia molowego / pH) roztworów użytych kwasów na szybkość reakcji.
Wybór czynności pozwalającej na wyodrębnienie składnika z mieszaniny. Zadanie 10. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W dwóch probówkach oznaczonych numerami I i II umieszczono jednakową ilość wiórków magnezowych o tym samym stopniu rozdrobnienia. Następnie do probówek wprowadzono jednakowe objętości roztworów o tej samej temperaturze:
– do probówki I – kwas solny o pH = 1
– do probówki II – wodny roztwór kwasu siarkowego(VI) o stężeniu 0,1 mol·dm–3 .
Przebieg doświadczenia zilustrowano poniższym rysunkiem.

Podczas opisanego doświadczenia w każdej probówce wiórki magnezowe uległy całkowitemu roztworzeniu i powstały klarowne, bezbarwne roztwory, ale w jednej z probówek reakcja przebiegła szybciej.
Którą czynność należy wykonać w celu wyodrębnienia z mieszaniny poreakcyjnej jonowego produktu otrzymanego w probówce I? Zaznacz właściwą odpowiedź spośród podanych. A. Sączenie B. Dekantacja C. Odwirowanie D. Odparowanie pod wyciągiem

