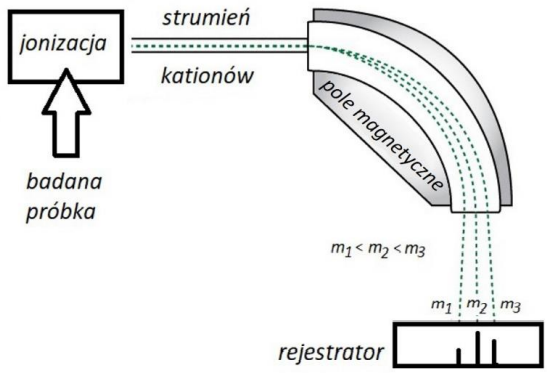
Wybór właściwych określeń z nawiasów dotyczących kinetyki reakcji. Zadanie 16.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br– + BrO3– + 6H+ → 3Br2 + 3H2O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br–] ⸱ [BrO3–] ⸱ [H+]2
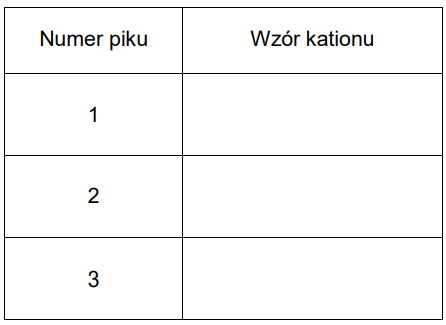
Stała szybkości reakcji w zależności od postaci równania kinetycznego może mieć różny wymiar. Niżej przedstawiono przykładowe wyrażenia oznaczone literami A–D.
![]()
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Stała szybkości reakcji utleniania jonów bromkowych jonami bromianowymi(V) ma jednostkę oznaczoną literą (A / B / C / D). Jedno z podanych wyrażeń nie może być jednostką stałej szybkości reakcji. To wyrażenie oznaczono literą (A / B / C / D).
Obliczanie jak zmieni się szybkość reakcji w wyniku zmiany pH roztworu. Zadanie 16.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Badano kinetykę reakcji utleniania jonów bromkowych jonami bromianowymi(V) w środowisku kwasowym, która przebiega zgodnie z równaniem:
5Br– + BrO3– + 6H+ → 3Br2 + 3H2O
Na podstawie pomiarów kinetycznych ustalono następującą zależność między szybkością tej reakcji a stężeniami reagentów:
𝑣 = 𝑘 ⸱ [Br–] ⸱ [BrO3–] ⸱ [H+]2
Oblicz, jak zmieni się szybkość opisanej reakcji, jeżeli początkowe pH roztworu będzie wyższe o 𝟎,𝟑.
Zapis wniosku na podstawie przeprowadzonego doświadczenia z udziałem chloroformu. Zadanie 17. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Na zdjęciu obok pokazano dwuetapowe doświadczenie, podczas którego do probówki wprowadzono kilka cm3 chloroformu (CHCl3) oraz wodę bromową (etap 1.), a następnie ciecze wymieszano i pozostawiono na pewien czas (etap 2.).

Przedstaw wniosek z pokazanego doświadczenia dotyczący porównania gęstości wody bromowej i chloroformu. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy. Gęstość chloroformu jest niż gęstość wody bromowej. Nazwa procesu:
Rozstrzygnięcie, czy dane rodzaje jonów można utlenić kwasem azotowym(V). Zadanie 18. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Jedna z metod wykrywania obecności jonów bromkowych albo jodkowych w roztworze polega na utlenieniu ich do wolnego bromu albo jodu.
Rozstrzygnij, czy zarówno jony bromkowe, jak i jony jodkowe można utlenić za pomocą kwasu azotowego(V). Uzasadnij swoją odpowiedź. W uzasadnieniu odnieś się do wartości odpowiednich potencjałów standardowych. Rozstrzygnięcie: jony bromkowe: jony jodkowe: Uzasadnienie:
Zapis schematów ogniw zbudowanych z półogniw metalicznych. Zadanie 19. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Zbudowano dwa ogniwa składające się z półogniw metalicznych (I rodzaju). W jednym z ogniw półogniwo cynkowe stanowi anodę, a w drugim – katodę. Wartości SEM tych ogniw różnią się o 59 mV.
Uzupełnij schematy opisanych ogniw. Elektrodą w dobieranym półogniwie powinien być jeden z wymienionych metali: mangan chrom żelazo kobalt miedź Schematy ogniw: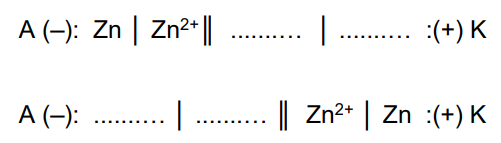
Zapis wzoru strukturalnego oraz nazwy systematycznej substratu użytego w reakcji polimeryzacji. Zadanie 20. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Związek organiczny X jest substratem w procesach produkcji niektórych tworzyw sztucznych. Ten związek ulega reakcji polimeryzacji i jest stosowany jako jeden z reagentów w procesach polikondensacji. Niżej przedstawione są wzory fragmentów łańcucha dwóch polimerów (oznaczonych literami A i B), w których syntezie bierze udział związek X.
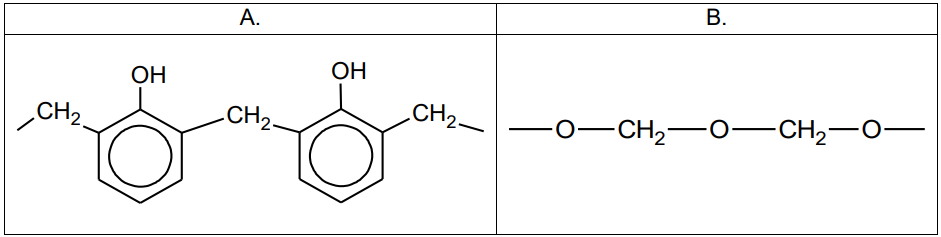
Uzupełnij tabelę. Wpisz informacje dotyczące związku X.
Zapis równania reakcji etynku sodu z wodą. Zadanie 22.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Atomy wodoru w cząsteczkach etynu są bardziej reaktywne niż atomy wodoru w alkanach i alkenach. Przykładowo: przez metaliczny sód jest wypierany wodór z etynu i przy nadmiarze tego alkinu reakcja przebiega zgodnie z równaniem:
2HC≡CH + 2Na → 2HC≡CNa + H2
Podobna reakcja z udziałem sodu zachodzi w ciekłym amoniaku:
2NH3 + 2Na → 2NaNH2 + H2
Z kolei działanie etynu na produkt tej reakcji (NaNH2) rozpuszczony w etoksyetanie (eterze dietylowym) prowadzi do ponownego powstania amoniaku:
HC≡CH + NaNH2 → HC≡CNa + NH3
Etynek sodu (HC≡CNa) nie jest trwałym związkiem i po wprowadzeniu do wody rozkłada się z wydzieleniem etynu.
Napisz w formie cząsteczkowej równanie reakcji etynku sodu z wodą.
Szeregowanie związków chemicznych według wzrastającego charakteru kwasowego. Zadanie 22.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Atomy wodoru w cząsteczkach etynu są bardziej reaktywne niż atomy wodoru w alkanach i alkenach. Przykładowo: przez metaliczny sód jest wypierany wodór z etynu i przy nadmiarze tego alkinu reakcja przebiega zgodnie z równaniem:
2HC≡CH + 2Na → 2HC≡CNa + H2
Podobna reakcja z udziałem sodu zachodzi w ciekłym amoniaku:
2NH3 + 2Na → 2NaNH2 + H2
Z kolei działanie etynu na produkt tej reakcji (NaNH2) rozpuszczony w etoksyetanie (eterze dietylowym) prowadzi do ponownego powstania amoniaku:
HC≡CH + NaNH2 → HC≡CNa + NH3
Etynek sodu (HC≡CNa) nie jest trwałym związkiem i po wprowadzeniu do wody rozkłada się z wydzieleniem etynu.
Etyn, amoniak i wodę uszereguj od najsłabszego do najsilniejszego charakteru kwasowego.
Wybór typu reakcji chemicznej oraz zapis wzorów półstrukturalnych związków chemicznych. Zadanie 23. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
Jedną z monobromopochodnych butanu (związek A) poddano reakcji z KOH w bezwodnym etanolu (reakcja 1.), a na otrzymany związek B podziałano bromowodorem (reakcja 2.). Główny produkt C był izomerem związku A.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Następnie uzupełnij tabelę. Napisz wzory półstrukturalne (grupowe) związków A i C. Związek B powstał w reakcji (substytucji / addycji / eliminacji), a jego przemiana w związek C jest przykładem reakcji (substytucji / addycji / eliminacji).
Opis wyglądu probówki po każdym etapie doświadczenia. Zadanie 24.1. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
W temperaturze powyżej 67 ℃ fenol miesza się z wodą w dowolnych proporcjach, natomiast w przedziale temperatury 15–40 ℃ jego maksymalne stężenie w roztworze wodnym nie przekracza 10 %.
Do probówki wprowadzono fenol i wodę w stosunku masowym 1 : 5 i przeprowadzono doświadczenie.
Etap 1. Zawartość probówki ogrzano do temperatury 70 ℃.
Etap 2. Mieszaninę ochłodzono do temperatury 25 ℃.
Etap 3. Dodano stechiometryczną ilość wodorotlenku sodu (w stosunku do fenolu).
Opisz wygląd zawartości probówki po kolejnych etapach doświadczenia. po 1. etapie: po 2. etapie: po 3. etapie
Zapis równania procesu którego przebieg odpowiada za zasadowy odczyn mieszaniny. Zadanie 24.2. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
W temperaturze powyżej 67 ℃ fenol miesza się z wodą w dowolnych proporcjach, natomiast w przedziale temperatury 15–40 ℃ jego maksymalne stężenie w roztworze wodnym nie przekracza 10 %.
Do probówki wprowadzono fenol i wodę w stosunku masowym 1 : 5 i przeprowadzono doświadczenie.
Etap 1. Zawartość probówki ogrzano do temperatury 70 ℃.
Etap 2. Mieszaninę ochłodzono do temperatury 25 ℃.
Etap 3. Dodano stechiometryczną ilość wodorotlenku sodu (w stosunku do fenolu).
Po pewnym czasie stwierdzono, że mieszanina otrzymana w 3. etapie ma odczyn zasadowy.
Napisz równanie reakcji odpowiadającej za odczyn tej mieszaniny na podstawie definicji kwasów i zasad Brønsteda. Wzory odpowiednich drobin wpisz w poniższą tabelę.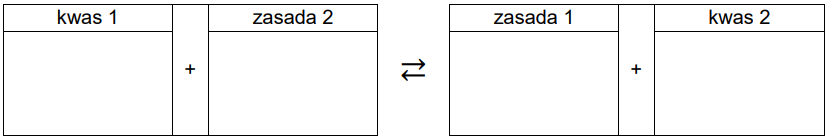
Projektowanie ciągu przemian w celu uzyskania 3-bromofenolu z benzenu. Zadanie 25. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (3 punkty)
W wyniku działania kwasem azotowym(III) na pierwszorzędowe aminy aromatyczne powstają tzw. sole diazoniowe, które znajdują zastosowanie w syntezie organicznej. W praktyce, zamiast nietrwałego kwasu azotowego(III) stosuje się jego sól w obecności
mocnego kwasu. Przykład takiej reakcji z udziałem aniliny zilustrowano równaniem:
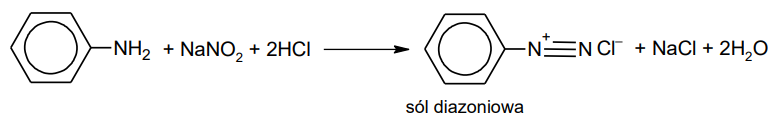
Gdy otrzymana sól diazoniowa reaguje z wodą, powstaje fenol.
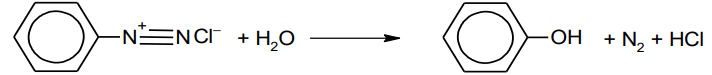
Opisane przemiany mogą być stosowane w celu otrzymania pochodnych benzenu, w których podstawniki kierujące w pozycje orto- i para- znajdują się względem siebie w pozycji meta-.
Zaprojektuj ciąg przemian, w wyniku których z benzenu powstanie 3-bromofenol – uzupełnij w poniższym, dwuczęściowym schemacie wzory produktów pośrednich, a nad każdą strzałką wpisz literę oznaczającą zestaw użytych reagentów. Zestawy odczynników wybierz spośród wymienionych poniżej.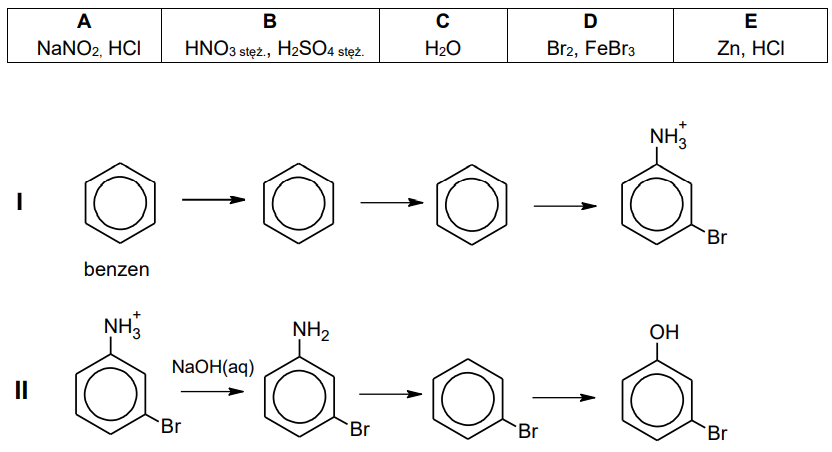
Rysowanie wzorów grupowych na podstawie fotografii ilustrujących przebieg doświadczenia. Zadanie 26. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (1 punkt)
Izomeryczne związki A, B i C należące do jednej klasy związków organicznych mają wzór sumaryczny C4H10O. Jeden z tych związków ma rozgałęziony łańcuch węglowy. Izomer A został wprowadzony do roztworu K2Cr2O7 z dodatkiem kwasu siarkowego(VI) i na zdjęciu obok pokazano, jak wygląda zawartość probówki na początku tego doświadczenia (1) oraz po pewnym czasie (2).

Wiadomo, że cząsteczki związku A nie są chiralne, ale jego izomer B, który podobnie zachowałby się w opisanym doświadczeniu, wykazuje czynność optyczną. Izomer C nie ulega działaniu jonów dichromianowych(VI).
Napisz wzory półstrukturalne (grupowe) izomerów A, B, C. Izomer A: Izomer B: Izomer C:
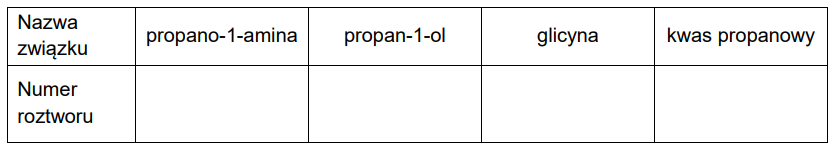
Przyporządkowanie roztworów do odpowiednich związków chemicznych na podstawie fotografii. Zadanie 27. Arkusz CKE chemia próbny grudzień 2022 rozszerzony (2 punkty)
Uczniowie badali zachowanie związków organicznych wobec kwasów i zasad. Mieli do dyspozycji: propano-1-aminę, propan-1-ol, glicynę oraz kwas propanowy. Te związki zostały w przypadkowej kolejności oznaczone numerami 1–4.
W pierwszym etapie doświadczenia badane związki wprowadzono pojedynczo do czterech probówek zawierających kwas solny z dodatkiem oranżu metylowego, a w drugim etapie – do czterech probówek zawierających roztwór NaOH z dodatkiem fenoloftaleiny.
Efekty doświadczenia pokazano na zdjęciach.

Uzupełnij tabelę. Wymienionym związkom przyporządkuj numery ich roztworów.