Zadanie 2.1. Wybór właściwej fotografii oraz zapis równania reakcji. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Przeprowadzono doświadczenie chemiczne z wykorzystaniem roztworu CuSO4 oraz jednego spośród metali – srebra, żelaza, glinu lub chromu. Schemat tego eksperymentu ilustrują fotografie:

Blaszkę widoczną na fotografii 3. umieszczono w stosunkowo dużym nadmiarze kwasu bromowodorowego. Jedna z spośród fotografii A – D przedstawia zmianę możliwą do zaobserwowania po wykonaniu tej czynności.

Wybierz właściwą fotografię, a następnie napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg jest przyczyną zmiany o której mowa. Oznaczenie literowe wybranej fotografii: Równanie reakcji chemicznej: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.2. Ocena z uzasadnieniem, czy obecna będzie faza stała. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Przeprowadzono doświadczenie chemiczne z wykorzystaniem roztworu CuSO4 oraz jednego spośród metali – srebra, żelaza, glinu lub chromu. Schemat tego eksperymentu ilustrują fotografie:

Blaszkę widoczną na fotografii 3. umieszczono w stosunkowo dużym nadmiarze kwasu bromowodorowego. Jedna z spośród fotografii A – D przedstawia zmianę możliwą do zaobserwowania po wykonaniu tej czynności.

Oceń, czy po zakończeniu doświadczenia w wybranej przez Ciebie probówce będzie znajdować się również faza stała. Odpowiedź uzasadnij odnosząc się do potencjałów redukcji odpowiednich półogniw. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 3. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

Napisz w formie jonowej skróconej równanie reakcji chemicznej w wyniku której nastąpiła widoczna na fotografii 4. względem fotografii 1. zmiana barwy fazy wodnej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.1. Zapis równań procesów - katodowego oraz anodowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

W trakcie opisanego doświadczenia na powierzchni magnezu tworzy się ogniwo chemiczne, w którym anodę stanowi aktywniejszy z metali. Na katodzie przebiega wówczas redukcja wody, co objawia się wydzielaniem widocznych na fotografiach 1.–3. drobnych pęcherzyków gazu.
Napisz w formie elektronowo-jonowej równania reakcji połówkowych jakie przebiegają na katodzie oraz anodzie w opisanym ogniwie. Proces katodowy: Proces anodowy: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 33.3. Wskazanie numeru właściwej probówki z zawartością. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Fotografie 1.–4. przedstawiają albuminę (białko jaja kurzego) poddaną procesowi denaturacji przy użyciu odczynników:
H2SO4(stężony), CuSO4(aq), HNO3(stężony), NaOH(stężony).

Wskaż numer tej probówki, w której za denaturację odpowiada wyłącznie obecność kationów metalu ciężkiego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.2. Wybór właściwego słowa w nawiasie. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

W trakcie opisanego doświadczenia na powierzchni magnezu tworzy się ogniwo chemiczne, w którym anodę stanowi aktywniejszy z metali. Na katodzie przebiega wówczas redukcja wody, co objawia się wydzielaniem widocznych na fotografiach 1.–3. drobnych pęcherzyków gazu.
Porównaj zawartości naczyń przedstawione na fotografiach 1. oraz 4. Następnie podkreśl właściwe słowo w nawiasie. Magnez jest metalem o gęstości (większej / mniejszej) niż miedź w stanie standardowym. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 5. Wskazanie właściwej fotografii oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Glin jest pierwiastkiem, którego powierzchnię pokrywa pasywna warstwa tlenku, dlatego wiele reakcji chemicznych z udziałem tego metalu przebiega dopiero po mechanicznym usunięciu tlenku, lub po umieszczeniu w roztworze o odczynie silnie zasadowym.
W trzech probówkach umieszczono blaszki aluminiowe, przy czym tylko jedną z nich zarysowano usuwając w ten sposób pasywną warstwę tlenku. Do dwóch probówek wprowadzono roztwór azotanu(V) srebra, do trzeciej natomiast – wodny roztwór odczynnika Tollensa – mocnego elektrolitu zawierającego związek kompleksowy o wzorze [Ag(NH3)2]OH. W jednej z probówek objawy reakcji zaobserwowano praktycznie natychmiast, a w kolejnej – dopiero po kilkunastu godzinach. Fotografie 1.–3. w sposób losowy przedstawiają zawartość każdej z probówek po 24 godzinach od momentu rozpoczęcia eksperymentu.

Wskaż numer tej probówki, w której umieszczona blaszka została zarysowana. Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Numer fotografii: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 7. Zapis wzoru sumarycznego, charakteru chemicznego oraz nazwy procesu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Fotografie 1. oraz 2. przedstawiają stalowe elementy zbrojenia budynku przed ich montażem. Zdjęcia wykonane zostały w odstępie kilku dni, podczas których wystąpiły opady deszczu.

Pomimo, że stosowany w budownictwie świeżo wylany beton ma odczyn silnie zasadowy, to barwny nalot widoczny na 2. fotografii nie wchodzi z nim w reakcję chemiczną.
Napisz wzór sumaryczny związku chemicznego pokrywającego elementy stalowe widoczne na 2. fotografii, określ jego charakter chemiczny oraz podaj nazwę wieloetapowego procesu chemicznego w wyniku którego powstaje opisana substancja. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 8. Wybór właściwych zestawów z uzasadnieniem. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Zamieszczone fotografie przedstawiają zestawy ocynkowanych (pokrytych ochronną warstwą cynku) stalowych wkrętów umieszczonych w różnych środowiskach. W każdym z zestawów fotografia 1. została wykonana 1 dzień po wprowadzeniu badanego elementu do określonego wodnego roztworu, natomiast fotografia 2. wykonana została 20 dni później.

Wskaż te zestawy wykorzystane podczas przedstawionego doświadczenia, w których nie zaobserwowano objawów korozji stali. Uzasadnij swój wybór. Wybrane zestawy: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9. Zapis nazwy zjawiska fizycznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Zamieszczone fotografie przedstawiają zestawy ocynkowanych (pokrytych ochronną warstwą cynku) stalowych wkrętów umieszczonych w różnych środowiskach. W każdym z zestawów fotografia 1. została wykonana 1 dzień po wprowadzeniu badanego elementu do określonego wodnego roztworu, natomiast fotografia 2. wykonana została 20 dni później.

Podaj nazwę zjawiska fizycznego w wyniku którego poziom cieczy w probówce 2. był każdorazowo niższy niż w probówce 1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
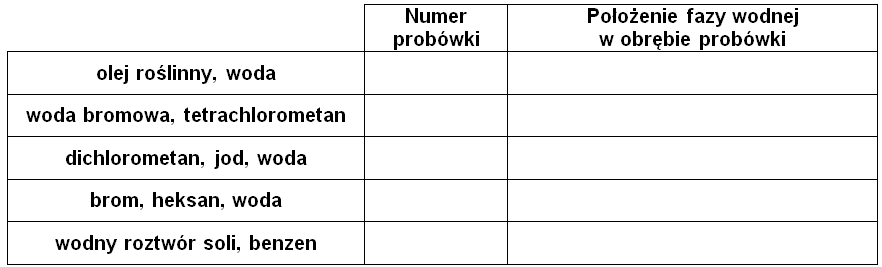
Zadanie 1.1. Przypisywanie numeru probówki do zawartości naczynia oraz wskazanie położenia fazy wodnej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Meniskiem nazywamy zakrzywioną powierzchnię utworzoną przez ciecz w wąskiej rurce. Występowanie menisku wklęsłego obserwujemy w przypadku takich cieczy, pomiędzy cząsteczkami których siły kohezji są mniejsze, niż siły adhezji ich cząsteczek do powierzchni szkła, co w szczególności obserwuje się w przypadku roztworów wodnych. Menisk wypukły możemy zaobserwować w przypadku takich substancji chemicznych, których cząsteczki słabo oddziałują ze szklanymi ściankami naczynia i praktycznie nie mieszają się z wodą. Znajomość zachowania się cieczy wobec ścianek naczynia często pozwala określić, która z warstw stanowi fazę wodną, a która roztwór z rozpuszczalnikiem organicznym.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Fotografie 1.–5. w sposób losowy ilustrują zawartości probówek stanowiące kombinacje składników zebranych w tabeli poniżej, przy czym jedynie probówka 4. nie była wstrząsana.

Przypisz numer probówki do odpowiedniej zawartości naczynia. Wskaż tę jego część, w której znajduje się faza wodna – wpisz słowo „górna” lub „dolna”. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone