Zadanie 5. Wskazanie właściwej fotografii oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Glin jest pierwiastkiem, którego powierzchnię pokrywa pasywna warstwa tlenku, dlatego wiele reakcji chemicznych z udziałem tego metalu przebiega dopiero po mechanicznym usunięciu tlenku, lub po umieszczeniu w roztworze o odczynie silnie zasadowym.
W trzech probówkach umieszczono blaszki aluminiowe, przy czym tylko jedną z nich zarysowano usuwając w ten sposób pasywną warstwę tlenku. Do dwóch probówek wprowadzono roztwór azotanu(V) srebra, do trzeciej natomiast – wodny roztwór odczynnika Tollensa – mocnego elektrolitu zawierającego związek kompleksowy o wzorze [Ag(NH3)2]OH. W jednej z probówek objawy reakcji zaobserwowano praktycznie natychmiast, a w kolejnej – dopiero po kilkunastu godzinach. Fotografie 1.–3. w sposób losowy przedstawiają zawartość każdej z probówek po 24 godzinach od momentu rozpoczęcia eksperymentu.

Wskaż numer tej probówki, w której umieszczona blaszka została zarysowana. Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Numer fotografii: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 7. Zapis wzoru sumarycznego, charakteru chemicznego oraz nazwy procesu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Fotografie 1. oraz 2. przedstawiają stalowe elementy zbrojenia budynku przed ich montażem. Zdjęcia wykonane zostały w odstępie kilku dni, podczas których wystąpiły opady deszczu.

Pomimo, że stosowany w budownictwie świeżo wylany beton ma odczyn silnie zasadowy, to barwny nalot widoczny na 2. fotografii nie wchodzi z nim w reakcję chemiczną.
Napisz wzór sumaryczny związku chemicznego pokrywającego elementy stalowe widoczne na 2. fotografii, określ jego charakter chemiczny oraz podaj nazwę wieloetapowego procesu chemicznego w wyniku którego powstaje opisana substancja. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 8. Wybór właściwych zestawów z uzasadnieniem. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Zamieszczone fotografie przedstawiają zestawy ocynkowanych (pokrytych ochronną warstwą cynku) stalowych wkrętów umieszczonych w różnych środowiskach. W każdym z zestawów fotografia 1. została wykonana 1 dzień po wprowadzeniu badanego elementu do określonego wodnego roztworu, natomiast fotografia 2. wykonana została 20 dni później.

Wskaż te zestawy wykorzystane podczas przedstawionego doświadczenia, w których nie zaobserwowano objawów korozji stali. Uzasadnij swój wybór. Wybrane zestawy: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9. Zapis nazwy zjawiska fizycznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Zamieszczone fotografie przedstawiają zestawy ocynkowanych (pokrytych ochronną warstwą cynku) stalowych wkrętów umieszczonych w różnych środowiskach. W każdym z zestawów fotografia 1. została wykonana 1 dzień po wprowadzeniu badanego elementu do określonego wodnego roztworu, natomiast fotografia 2. wykonana została 20 dni później.

Podaj nazwę zjawiska fizycznego w wyniku którego poziom cieczy w probówce 2. był każdorazowo niższy niż w probówce 1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 1.1. Przypisywanie numeru probówki do zawartości naczynia oraz wskazanie położenia fazy wodnej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Meniskiem nazywamy zakrzywioną powierzchnię utworzoną przez ciecz w wąskiej rurce. Występowanie menisku wklęsłego obserwujemy w przypadku takich cieczy, pomiędzy cząsteczkami których siły kohezji są mniejsze, niż siły adhezji ich cząsteczek do powierzchni szkła, co w szczególności obserwuje się w przypadku roztworów wodnych. Menisk wypukły możemy zaobserwować w przypadku takich substancji chemicznych, których cząsteczki słabo oddziałują ze szklanymi ściankami naczynia i praktycznie nie mieszają się z wodą. Znajomość zachowania się cieczy wobec ścianek naczynia często pozwala określić, która z warstw stanowi fazę wodną, a która roztwór z rozpuszczalnikiem organicznym.
Na podstawie: P. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Fotografie 1.–5. w sposób losowy ilustrują zawartości probówek stanowiące kombinacje składników zebranych w tabeli poniżej, przy czym jedynie probówka 4. nie była wstrząsana.

Przypisz numer probówki do odpowiedniej zawartości naczynia. Wskaż tę jego część, w której znajduje się faza wodna – wpisz słowo „górna” lub „dolna”. Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone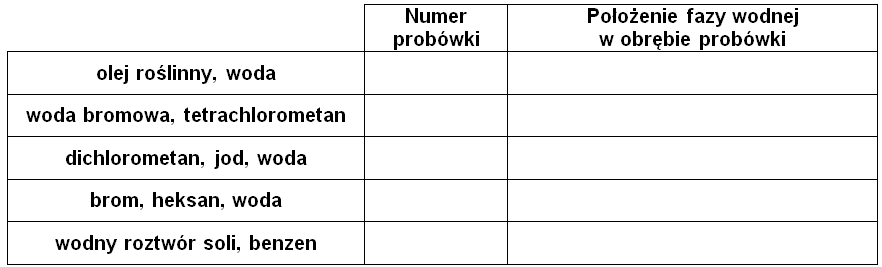
Zadanie 2. Przypisywanie numeru frakcji do odpowiedniej substancji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
W tabeli poniżej zebrano informacje na temat gęstości (g∙cm–3) wybranych cieczy (25 oC, 1013 hPa), a zamieszczone zdjęcie ilustruje zawartość probówki, w której znajdują się wymienione w tabeli związki chemiczne. Dla zwiększenia czytelności fotografii niektóre z widocznych warstw zostały zabarwione, przy czym ich gęstości praktycznie równe są gęstości czystego rozpuszczalnika.

Nazwom substancji przypisz właściwe numery 1.–4. opisujące poszczególne frakcje w probówce. Uzupełnij puste pola w tabeli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone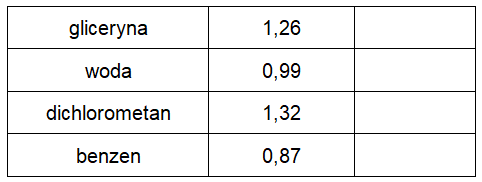
Zadanie 3. Wyjaśnienie uzyskanego efektu po wstrząśnięciu zawartością probówki. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
W dwóch naczyniach znajdowały się – dichlorometan oraz etylobenzen. Próbkę jednego z tych związków chemicznych poddano badaniu wykonując ciąg czynności według schematu:

Wyjaśnij, dlaczego po wstrząśnięciu zawartością naczynia widoczną na 2. fotografii uzyskano efekt, który przedstawia fotografia 3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4. Zapis równania reakcji chemicznej oraz obliczeń. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (2 punkty)
W dwóch naczyniach znajdowały się – dichlorometan oraz etylobenzen. Próbkę jednego z tych związków chemicznych poddano badaniu wykonując ciąg czynności według schematu:

Wykonaj niezbędne obliczenia, a następnie napisz równanie reakcji chemicznej, której przebieg doprowadził do zmian zawartości probówki 3. w zawartość widoczną na 4. fotografii. Przyjmij, że przekształcając się w produkt, masa 0,01 mola cząsteczek bezbarwnego substratu wzrosła o 1,58 g. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 5. Wybór właściwych piktogramów ostrzegawczych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Pomimo, że benzen oraz metylobenzen (toluen) należą do tego samego szeregu homologicznego, to jednak znacząco różnią się reaktywnością, co wynika z różnej struktury ich cząsteczek.
Zaznacz dwa spośród podanych piktogramów ostrzegawczych, które są wspólne dla benzenu oraz metylobenzenu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone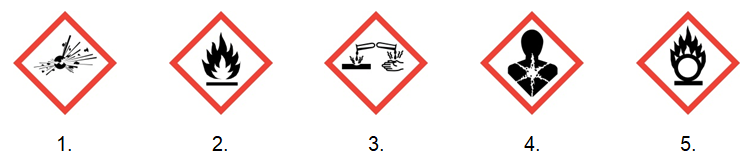
Zadanie 6.1. Rysowanie wzorów grupowych związków przypisanych do właściwych fotografii. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Pomimo, że benzen oraz metylobenzen (toluen) należą do tego samego szeregu homologicznego, to jednak znacząco różnią się reaktywnością, co wynika z różnej struktury ich cząsteczek.
W celu sprawdzenia, który z wymienionych związków łatwiej wchodzi w reakcję chemiczną w tej samej temperaturze, próbki tych węglowodorów umieszczono w dwóch probówkach. Do każdego z naczyń wprowadzono następnie zakwaszony roztwór dwuchromianu(VI) potasu. Po energicznym, kilkudziesięciosekundowym wstrząsaniu zawartością probówek uzyskano układy przedstawione na fotografiach 1. oraz 2.

Narysuj wzory grupowe lub uproszczone cząsteczek węglowodorów przypisując je do odpowiednich fotografii. Fotografia 1.: Fotografia 2.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone



