Zadanie 1. Zapis skróconej elektronowej konfiguracji podpowłokowej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Stosując symbole podpowłok napisz skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową atomu pierwiastka X w stanie podstawowym. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.1. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Substancje widoczne na fotografiach 1. oraz 2. umieszczono w zlewkach, w których znajdowała się woda destylowana w takich ilościach, że uzyskano klarowne roztwory. Próbki powstałych mieszanin wprowadzono następnie do tej samej probówki, co dało efekt końcowy widoczny na zamieszczonej poniżej fotografii.

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Zastosuj metodę bilansu jonowo-elektronowego. W równaniach reakcji połówkowych uwzględnij, że jednym z substratów jest woda. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.2. Wybór probówki oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
O pewnym pierwiastku chemicznym X wiadomo, że w stanie podstawowym zarówno jego atom jak i dwudodatni jon zawierają po pięć elektronów niesparowanych. Zamieszczone fotografie ilustrują związki tego pierwiastka, w których występuje on na najniższym (fotografia 1.) oraz najwyższym (fotografia 2.) stopniu utlenienia.

Substancje widoczne na fotografiach 1. oraz 2. umieszczono w zlewkach, w których znajdowała się woda destylowana w takich ilościach, że uzyskano klarowne roztwory. Próbki powstałych mieszanin wprowadzono następnie do tej samej probówki, co dało efekt końcowy widoczny na zamieszczonej poniżej fotografii.

Przedstawioną na zamieszczonej fotografii zawiesinę można uzyskać również w wyniku reakcji zawartości jednej z probówek A, B lub C z nadtlenkiem wodoru.
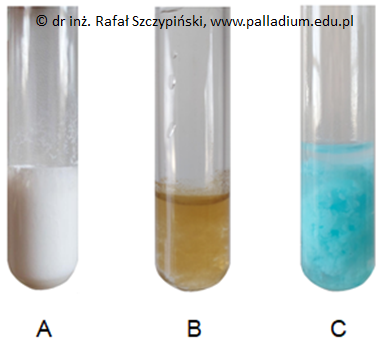
Wskaż właściwą probówkę (A, B lub C) oraz napisz równanie opisanej reakcji chemicznej. Oznaczenie probówki: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 3. Zapis wzorów reduktorów oraz postaci do jakich są utleniane. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Uzupełnij puste pola w tabeli – wpisz wzór sumaryczny drobiny pełniącej rolę reduktora w danej probówce oraz wzór sumaryczny drobiny powstałej w wyniku jej utlenienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.1. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Drobiny, których obecność świadczy o barwie widocznej na 1. fotografii umownie oznaczono literą X. Zakwaszenie tej mieszaniny poreakcyjnej pozwala na szybkie przekształcenie jej w osad przedstawiony na 2. fotografii. Podczas takiej przemiany powstają również jony, których obecność świadczy o barwie fazy wodnej widocznej na fotografii A.

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiega w trakcie opisanego procesu z udziałem drobin X. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.2. Określanie typu reakcji redoks. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
W trzech probówkach znajdowały się roztwory – kwasu solnego, wodorotlenku potasu oraz siarczanu(IV) sodu. W celu odróżnienia zawartości naczyń do każdego z nich wprowadzono wodny roztwór manganianu(VII) potasu i lekko ogrzano. Zamieszczone fotografie przedstawiają zawartość probówek uzyskaną po wykonaniu opisanych czynności.

Drobiny, których obecność świadczy o barwie widocznej na 1. fotografii umownie oznaczono literą X. Zakwaszenie tej mieszaniny poreakcyjnej pozwala na szybkie przekształcenie jej w osad przedstawiony na 2. fotografii. Podczas takiej przemiany powstają również jony, których obecność świadczy o barwie fazy wodnej widocznej na fotografii A.

Dokonaj klasyfikacji procesu redoks z udziałem drobin X. Podkreśl właściwe słowo w nawiasie. Uzasadnij swój wybór. Opisany proces jest przykładem reakcji (synproporcjonacji / dysproporcjonacji). Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 5. Zapis wzoru sumaryczne go związku oraz typu tworzonych kryształów. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Napisz wzór sumaryczny związku chemicznego X, a następnie określ rodzaj tworzonych przez tę substancję kryształów (kowalencyjne, molekularne, jonowe). Uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone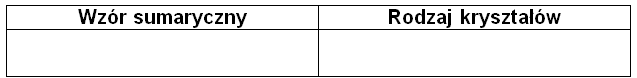
Zadanie 6. Ocena, czy wskazany związek chemiczny wykazuje właściwości utleniające. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Oceń, czy przeprowadzone doświadczenie pozwala stwierdzić, że związek chemiczny X wykazuje właściwości utleniające. Uzasadnij odpowiedź. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 8.2. Zapis podpowłokowej konfiguracji elektronowej jonu. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Fotografia 1. ilustruje pewien związek chemiczny X zawierający około 26,5% masowych potasu oraz tlen i pierwiastek bloku d. W stanie podstawowym atomu tego pierwiastka wszystkie elektrony walencyjne są niesparowane. Opisaną substancję wprowadzono do zlewki zawierającej wodę destylowaną i całkowicie rozpuszczono. Z uzyskanej mieszaniny pobrano następnie po 2 ml próbek i umieszczono w trzech probówkach. Do naczyń tych w sposób losowy oraz w nadmiarze wprowadzono roztwory – KOH, H2SO4 oraz wodę destylowaną. Efekt końcowy tego doświadczenia przedstawiają fotografie 2.–4.

Do zawartości jednej z probówek widocznych na fotografiach 2.–4. wprowadzono wodny roztwór pewnego związku chemicznego. Standardowy potencjał redukcji półogniwa, w którym związek ten stanowi formę zredukowaną wynosi 0,695 V. Zamieszczona poniżej fotografia została wykonana w trakcie przebiegu opisanej reakcji chemicznej.

Napisz stosując symbole podpowłok pełną konfigurację elektronową powstającego jonu, którego obecność przyczynia się do zmiany zabarwienia roztworu na widoczny kolor. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.1. Wskazanie właściwej fotografii oraz zapis wzoru sumarycznego związku chemicznego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Wskaż fotografię (A, B lub C) przedstawiającą związek chemiczny, którego roztwór uzyskano w wyniku przebiegu opisanej reakcji chemicznej. Napisz jego wzór sumaryczny. Wybrana fotografia: Wzór sumaryczny: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 9.2. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Jeśli do zalkalizowanej zawartości probówki 2. wprowadzony zostanie nadtlenek wodoru, wówczas powstanie roztwór zawierający związek chemiczny, którego krystaliczną postać przedstawia jedna z fotografii:

Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. Proces utleniania: Proces redukcji: Równanie sumaryczne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 10. Wskazanie właściwej fotografii oraz zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

Fotografia 1. przedstawia tlenek chromu(III). Zawartość probówki 2. stanowi klarowny roztwór, w którym występują jony kompleksowe o liczbie koordynacyjnej 6, natomiast w probówce 3. znajduje się zawiesina pewnego związku chromu.
Związek przedstawiony na 1. fotografii wprowadzono do niewielkiego nadmiaru roztworu kwasu siarkowego(VI). Uzyskano wówczas mieszaninę przedstawioną na jednaj z fotografii (A, B, C lub D).

Wskaż oznaczenie literowe właściwej fotografii. Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Wybrana fotografia: Równanie reakcji: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone


