Zadanie 20. Zapis podpowłokowej konfiguracji elektronowej odpowiednich kationów żelaza. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:
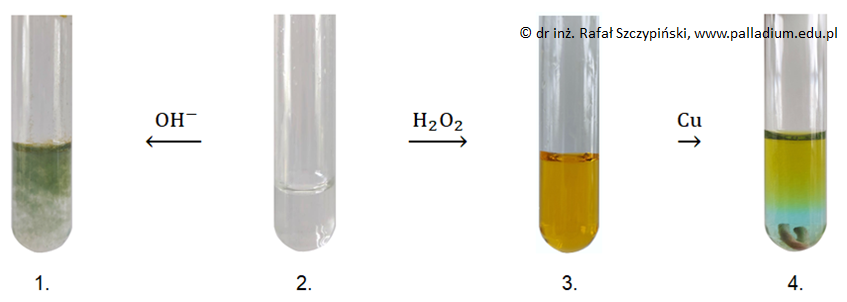
W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Stosując symbole podpowłok napisz konfigurację elektronową tych kationów żelaza, w których pierwiastek ten przyjmuje największy podczas opisanego doświadczenia stopień utlenienia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.1. Zapis równań reakcji chemicznych. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (2 punkty)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Po wprowadzeniu wodnego roztworu odpowiedniego odczynnika – nadtlenku wodoru lub w wodorotlenku sodu – do widocznych na fotografiach 1. oraz 3. zawartości probówek można uzyskać ten sam związek chemiczny, którego zawiesinę przedstawia zamieszczona poniżej fotografia.

Napisz równania reakcji chemicznych jakie przebiegły z udziałem zawartości probówek 1. oraz 3., w wyniku których powstał osad o którym mowa. Probówka 1.: Probówka 3.: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.2. Wskazanie nazwy zjawiska oraz nazwy metody rozdziału mieszanin. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Po wprowadzeniu wodnego roztworu odpowiedniego odczynnika – nadtlenku wodoru lub w wodorotlenku sodu – do widocznych na fotografiach 1. oraz 3. zawartości probówek można uzyskać ten sam związek chemiczny, którego zawiesinę przedstawia zamieszczona poniżej fotografia.

Po energicznym wstrząśnięciu zawartością tej probówki, do której wprowadzono roztwór NaOH naczynie fotografowano co kilka minut od momentu wykonania opisanej czynności:

Podaj nazwę zjawiska widocznego na czterech powyższych fotografiach, a następnie napisz nazwę metody rozdziału mieszanin, która wykorzystuje przedstawione zjawisko. Nazwa zjawiska: Nazwa metody: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 21.3. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Po wprowadzeniu wodnego roztworu odpowiedniego odczynnika – nadtlenku wodoru lub w wodorotlenku sodu – do widocznych na fotografiach 1. oraz 3. zawartości probówek można uzyskać ten sam związek chemiczny, którego zawiesinę przedstawia zamieszczona poniżej fotografia.

W wyniku prażenia ciała stałego stanowiącego przedstawiony czerwonobrunatny osad powstaje związek chemiczny, który reaguje z glinem przekształcając go w tlenek. Z uwagi na wysoką wartość efektu cieplnego tej przemiany, powstający w trakcie jej przebiegu metal występuje w ciekłym stanie skupienia.
Napisz równanie tej reakcji chemicznej, jaka przebiega z udziałem glinu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 22. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Przeprowadzono doświadczenie chemiczne według schematu:

W probówce 2. znajdował się wodny roztwór powstały w wyniku reakcji nadmiaru kwasu solnego z próbką metalu pochodzącą ze stalowego pręta. Po zakończeniu reakcji w wyniku której powstał roztwór w 3. probówce, nie stwierdzono obecności nadtlenku wodoru w tym naczyniu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej prowadzącej do powstania zawartości 4. probówki. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 23.1. Wybór fotografii z uzasadnieniem. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Cynk w reakcji z mocnymi zasadami tworzy hydroksokompleksy o liczbie koordynacyjnej 4. Do wodnego roztworu wodorotlenku potasu wprowadzono próbkę cynku.
Spośród zamieszczonych niżej fotografii wybierz tę, która przedstawia opisane naczynie chwilę po umieszczeniu w nim próbki metalu. Uzasadnij swój wybór – odnieś się do określonych objawów reakcji. Wybrana fotografia: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 23.2. Zapis równania reakcji chemicznej cynku z zasadą potasową. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
Cynk w reakcji z mocnymi zasadami tworzy hydroksokompleksy o liczbie koordynacyjnej 4. Do wodnego roztworu wodorotlenku potasu wprowadzono próbkę cynku.
Napisz w formie jonowej skróconej równanie reakcji chemicznej cynku z zasadą potasową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 24. Wskazanie metali wchodzących w skład monety. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.1 (1 punkt)
W celu ustalenia składu jakościowego pewnej monety przeprowadzono kilkuetapowe doświadczenie chemiczne. W tym celu analizowany stop metali podzielony został na dwie próbki.
Próbkę 1. wprowadzono do nadmiaru kwasu solnego. Po usunięciu nieprzereagowanego ciała stałego, do roztworu dodano najpierw zasadę potasową (fotografia 1.), a następnie roztwór H2O2 (fotografia 2.).
Próbkę 2. poddano działaniu stężonego roztworu kwasu azotowego(V). Powstały klarowny roztwór poddano działaniu wody amoniakalnej w niedomiarze (fotografia 3.) i w nadmiarze (fotografia 4.).

Spośród wymienionych niżej symboli metali podkreśl takie dwa, które na pewno wchodziły w skład badanej monety. Ca Fe Ag Cu Pb Au © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 1. Zapis równania reakcji oraz wybór właściwych słów w nawiasach. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (2 punkty)
Przeprowadzono doświadczenie chemiczne z wykorzystaniem roztworu CuSO4 oraz jednego spośród metali – srebra, żelaza, glinu lub chromu. Schemat tego eksperymentu ilustrują fotografie:

Zapisz w formie jonowej skróconej równanie reakcji chemicznej w wyniku przebiegu której powstała zawartość probówki widoczna na 2. fotografii, a następnie podkreśl właściwe słowa w nawiasach odnoszące się do zmiany mas – blaszki wykorzystanej w tym doświadczeniu oraz roztworu. Równanie reakcji: Masa widocznej na 2. fotografii fazy wodnej była (większa / mniejsza) niż przed rozpoczęciem reakcji chemicznej. Masa blaszki wraz z osadzonym na niej metalem była (większa / mniejsza) niż przed rozpoczęciem doświadczenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.1. Wybór właściwej fotografii oraz zapis równania reakcji. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Przeprowadzono doświadczenie chemiczne z wykorzystaniem roztworu CuSO4 oraz jednego spośród metali – srebra, żelaza, glinu lub chromu. Schemat tego eksperymentu ilustrują fotografie:

Blaszkę widoczną na fotografii 3. umieszczono w stosunkowo dużym nadmiarze kwasu bromowodorowego. Jedna z spośród fotografii A – D przedstawia zmianę możliwą do zaobserwowania po wykonaniu tej czynności.

Wybierz właściwą fotografię, a następnie napisz w formie jonowej skróconej równanie reakcji chemicznej, której przebieg jest przyczyną zmiany o której mowa. Oznaczenie literowe wybranej fotografii: Równanie reakcji chemicznej: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 2.2. Ocena z uzasadnieniem, czy obecna będzie faza stała. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Przeprowadzono doświadczenie chemiczne z wykorzystaniem roztworu CuSO4 oraz jednego spośród metali – srebra, żelaza, glinu lub chromu. Schemat tego eksperymentu ilustrują fotografie:

Blaszkę widoczną na fotografii 3. umieszczono w stosunkowo dużym nadmiarze kwasu bromowodorowego. Jedna z spośród fotografii A – D przedstawia zmianę możliwą do zaobserwowania po wykonaniu tej czynności.

Oceń, czy po zakończeniu doświadczenia w wybranej przez Ciebie probówce będzie znajdować się również faza stała. Odpowiedź uzasadnij odnosząc się do potencjałów redukcji odpowiednich półogniw. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 3. Zapis równania reakcji chemicznej. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

Napisz w formie jonowej skróconej równanie reakcji chemicznej w wyniku której nastąpiła widoczna na fotografii 4. względem fotografii 1. zmiana barwy fazy wodnej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.1. Zapis równań procesów - katodowego oraz anodowego. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

W trakcie opisanego doświadczenia na powierzchni magnezu tworzy się ogniwo chemiczne, w którym anodę stanowi aktywniejszy z metali. Na katodzie przebiega wówczas redukcja wody, co objawia się wydzielaniem widocznych na fotografiach 1.–3. drobnych pęcherzyków gazu.
Napisz w formie elektronowo-jonowej równania reakcji połówkowych jakie przebiegają na katodzie oraz anodzie w opisanym ogniwie. Proces katodowy: Proces anodowy: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 33.3. Wskazanie numeru właściwej probówki z zawartością. Doświadczenia chemiczne w zadaniach część 1. Rozdział 5 (1 punkt)
Fotografie 1.–4. przedstawiają albuminę (białko jaja kurzego) poddaną procesowi denaturacji przy użyciu odczynników:
H2SO4(stężony), CuSO4(aq), HNO3(stężony), NaOH(stężony).

Wskaż numer tej probówki, w której za denaturację odpowiada wyłącznie obecność kationów metalu ciężkiego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zadanie 4.2. Wybór właściwego słowa w nawiasie. Doświadczenia chemiczne w zadaniach część 1. Rozdział 4.2 (1 punkt)
Do wodnego roztworu siarczanu(VI) miedzi(II) wprowadzono wiórki magnezowe. Fotografie 1.–4. przedstawiają zmiany zawartości naczynia jakie nastąpiły w ciągu 15 minut od momentu rozpoczęcia doświadczenia chemicznego.

W trakcie opisanego doświadczenia na powierzchni magnezu tworzy się ogniwo chemiczne, w którym anodę stanowi aktywniejszy z metali. Na katodzie przebiega wówczas redukcja wody, co objawia się wydzielaniem widocznych na fotografiach 1.–3. drobnych pęcherzyków gazu.
Porównaj zawartości naczyń przedstawione na fotografiach 1. oraz 4. Następnie podkreśl właściwe słowo w nawiasie. Magnez jest metalem o gęstości (większej / mniejszej) niż miedź w stanie standardowym. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

