Znaleziono 27 wyników wyszukiwania dla słowa: Miareczkowanie
TEMAT VII. Wykład: równowagi w roztworach wodnych, część 2 – wskaźniki pH, miareczkowanie, przewodnictwo roztworów elektrolitów
Podczas tego wykładu omówione zostały zagadnienia związane z miareczkowaniem oraz przewodnictwem roztworów elektrolitów.
Film podzielony jest na rozdziały. Możesz wybrać dowolny z nich, klikając na pasek postępu w odtwarzaczu.
0:00 Wstęp
0:13 Wskaźniki alkacymetryczne, działanie, zakres wskaźnikowy
07:18 Miareczkowanie alkacymetryczne – informacje ogólne
8:37 Punkt równoważnikowy miareczkowania
9:57 Krzywa miareczkowania
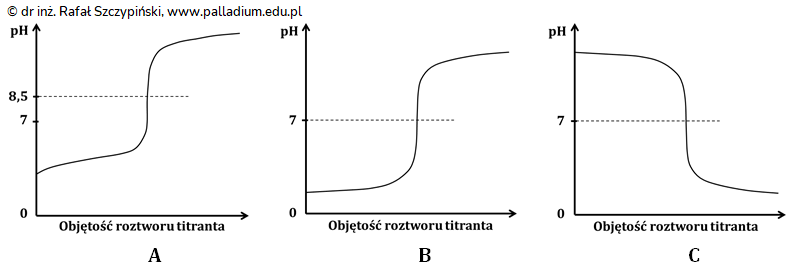
10:33 Przebieg krzywej miareczkowania roztworu mocnej zasady roztworem mocnego kwasu
12:35 Przebieg krzywej miareczkowania roztworu mocnego kwasu roztworem mocnej zasady
13:26 Przykład miareczkowania z danymi liczbowymi
19:09 Przebieg krzywej miareczkowania roztworu słabej zasady roztworem mocnego kwasu
24:10 Przebieg krzywej miareczkowania roztworu słabego kwasu roztworem mocnej zasady
28:19 Miareczkowanie roztworów wieloprotonowych kwasów roztworami mocnych zasad
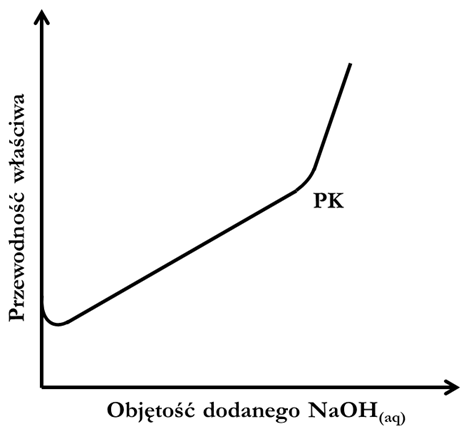
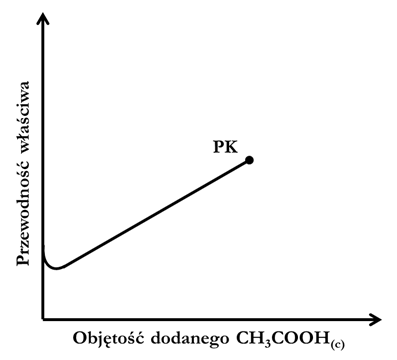
31:40 Wykorzystanie przewodnictwa elektrycznego roztworu w miareczkowaniu
34:00 Miareczkowanie konduktometryczne – informacje ogólne
35:17 Miareczkowanie konduktometryczne – zmiany przewodnictwa roztworu gdy nie strąca się osad
38:15 Miareczkowanie konduktometryczne – zmiany przewodnictwa roztworu gdy strąca się osad
Po obejrzeniu tej lekcji należy zapoznać się z następującymi tutorialami oraz artykułami:
1. Jak działa wskaźnik alkacymetryczny?
2. Jak dobrać wskaźnik alkacymetryczny?
3. Miareczkowanie alkacymetryczne.
Czas trwania wykładu: 41 minut 21 sekund. Forma wykładu: film – prezentacja multimedialna z lektorem (Rafał Szczypiński).
Identyfikacja roztworu kwasu wskaźnikiem alkacymetrycznym na podstawie obliczonej wartości pH (miareczkowanie). Podręcznik Podręcznik 5.3 zad. 2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.
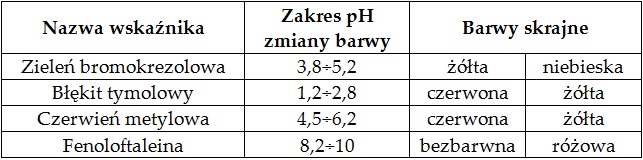
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W dwóch różnych probówkach umieszczono po 3 cm3 wodnych roztworów kwasów, przy czym były to 0,5-molowy kwas chlorowy(III), a w drugiej kwas etanowy o stężeniu 0,01 mol∙dm–3.
Wykonaj stosowne obliczenia, a następnie dysponując jedynie wymienionymi wskaźnikami alkacymetrycznymi, zaprojektuj doświadczenie, którego celem będzie identyfikacja każdego z roztworów kwasów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego powstałego roztworu octanu sodu w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 3.1
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór kwasu octowego wobec pewnego wskaźnika alkacymetrycznego, którego nazwę wymieniono w tabeli, w informacji wprowadzającej. Jako titrant zastosowano wodny roztwór wodorotlenku sodu. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 8,9.
Oblicz stężenie molowe uzyskanego roztworu soli w punkcie równoważnikowym miareczkowania. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego wskaźnika kwasowo-zasadowego podczas miareczkowania roztworu kwasu octowego (miareczkowanie). Podręcznik 5.3 zad. 3.2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór kwasu octowego wobec pewnego wskaźnika alkacymetrycznego, którego nazwę wymieniono w tabeli, w informacji wprowadzającej. Jako titrant zastosowano wodny roztwór wodorotlenku sodu. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 8,9.
Podaj nazwę wskaźnika alkacymetrycznego, jaki został wykorzystany podczas opisanego doświadczenia. Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego powstałego roztworu bromku etyloamoniowego w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 4.1
Miareczkowano wodny roztwór etyloaminy wobec czerwieni metylowej. Jako titrant zastosowano wodny roztwór kwasu bromowodorowego. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 5,7.
Oblicz stężenie molowe uzyskanego roztworu soli w punkcie równoważnikowym miareczkowania. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie przyczyny określonego odczynu wodnego roztworu bromku etyloamoniowego w punkcie równoważnikowym miareczkowania wraz z uzasadnieniem (miareczkowanie). Podręcznik 5.3 zad. 4.2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór etyloaminy wobec czerwieni metylowej. Jako titrant zastosowano wodny roztwór kwasu bromowodorowego. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 5,7.
Podaj nazwę procesu, którego przebieg warunkuje taki, a nie inny odczyn roztworu uzyskanego w punkcie równoważnikowym podczas tego doświadczenia. Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy możliwe jest wykorzystanie innego wskaźnika alkacymetrycznego podczas miareczkowania roztworu etyloaminy (miareczkowanie). Podręcznik 5.3 zad. 4.3
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór etyloaminy wobec czerwieni metylowej. Jako titrant zastosowano wodny roztwór kwasu bromowodorowego. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 5,7.
Oceń, czy możliwe byłoby użycie zieleni bromokrezolowej jako wskaźnika alkacymetrycznego, zamiast czerwieni metylowej podczas opisanego procesu miareczkowania? Uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących osiągnięciu punktu równoważnikowego miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 5
Zmiareczkowano 400 cm3 wodnego roztworu wodorotlenku wapnia wobec fenoloftaleiny. Punkt równoważnikowy osiągnięto po wprowadzeniu 20 cm3 roztworu titranta, którym był roztwór kwasu solnego o stężeniu 0,2 mol∙dm–3.
Napisz, co zaobserwowano w momencie osiągnięcia punktu równoważnikowego miareczkowania? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie początkowej wartości pH miareczkowanego roztworu (miareczkowanie). Podręcznik 5.3 zad. 6
Zmiareczkowano 400 cm³ wodnego roztworu wodorotlenku wapnia wobec fenoloftaleiny. Punkt równoważnikowy osiągnięto po wprowadzeniu 20 cm³ roztworu titranta, którym był roztwór kwasu solnego o stężeniu 0,2 mol∙dm–3.
Oblicz początkową wartość pH roztworu analitu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie, czy możliwe jest zastosowanie innego wskaźnika alkacymetrycznego podczas miareczkowania roztworu wodorotlenku wapnia (miareczkowanie). Podręcznik 5.3 zad. 7
Zakres wskaźnikowy oranżu metylowego odpowiada wartościom pH z zakresu 3,2÷4,4.
Na podstawie: W. Mizerski, Tablice chemiczne, Adamantan 2013.
Zmiareczkowano 400 cm3 wodnego roztworu wodorotlenku wapnia wobec fenoloftaleiny. Punkt równoważnikowy osiągnięto po wprowadzeniu 20 cm3 roztworu titranta, którym był roztwór kwasu solnego o stężeniu 0,2 mol∙dm–3.
Napisz, czy w doświadczeniu tym jako wskaźnik alkacymetryczny mógłby zostać wykorzystany oranż metylowy? Odpowiedź uzasadnij. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 8
Zmiareczkowano 400 cm3 wodnego roztworu wodorotlenku wapnia wobec fenoloftaleiny. Punkt równoważnikowy osiągnięto po wprowadzeniu 20 cm3 roztworu titranta, którym był roztwór kwasu solnego o stężeniu 0,2 mol∙dm–3.
Oceń, czy wartość pH roztworu w punkcie równoważnikowym miareczkowania byłaby większa, mniejsza, czy równa 7, gdyby zamiast miareczkowanego roztworu wodorotlenku wapnia użyto roztwór kwasu mrówkowego, a titrantem był wówczas wodny roztwór wodorotlenku potasu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH miareczkowanego roztworu wodorotlenku baru w określonym momencie miareczkowania (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
Jaka była wartość pH miareczkowanego roztworu w momencie zobojętnienia połowy początkowej liczby jonów wodorotlenkowych, pochodzących z dysocjacji elektrolitycznej zasady barowej? Wynik podaj z dokładnością do dwóch cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego oraz pH zmiareczkowanego roztworu (miareczkowanie)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oblicz, jakie było stężenie molowe zmiareczkowanego roztworu kwasu oraz jego pH? Przyjmij, że powstały w pierwszym etapie dysocjacji anion wodorosiarczanowy(VI) dysocjuje całkowicie. Wyniki obliczeń podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH zmiareczkowanego roztworu wodorotlenku baru (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
Ustal wartość pH miareczkowanego roztworu wodorotlenku baru. Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie pH roztworu titranta (miareczkowanie)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oblicz, jakie było pH roztworu wykorzystanego do zmiareczkowania roztworu kwasu siarkowego(VI)? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu w punkcie równoważnikowym miareczkowania, przy określonej wartości pH (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
W zakresie pH 6,2÷7,6 roztwory zawierające błękit bromotymolowy mają kolor zielony. Określ, czy w punkcie równoważnikowym miareczkowany roztwór przyjął podane zabarwienie? Odpowiedź uzasadnij jednym zdaniem. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie w jakim stosunku molowym zmieszano propano-1-aminę z butano-1-aminą (miareczkowanie)
Próbkę o masie 2,57 g stanowiącą propano-1-aminę oraz butano-1-aminę wprowadzono do wody destylowanej i przeprowadzono miareczkowanie wykorzystując 90 cm3 roztworu kwasu bromowodorowego o stężeniu 0,5 mol∙dm–3. Nadmiar kwasu zobojętniono za pomocą 62,5 cm3 0,08-molowego roztworu wodorotlenku potasu.
Na podstawie niezbędnych obliczeń ustal, w jakim stosunku molowym pozostawały względem siebie aminy w próbce poddanej miareczkowaniu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu etyloaminy poddanego miareczkowaniu (miareczkowanie)
Miareczkowano wodny roztwór etanoaminy zawierający 150 mg tej substancji chemicznej. Jako titrant zastosowano 0,1-molowy roztwór kwasu solnego. Punkt równoważnikowy osiągnięto, gdy objętość zmiareczkowanego roztworu była równa 250 cm3.
Pomijając zjawisko kontrakcji, oblicz wartość pH roztworu etanoaminy poddanego miareczkowaniu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego kwasu jednokarboksylowego wykorzystując miareczkowanie
W kolbie stożkowej zawierającej 100 cm3 wody destylowanej z dodatkiem kilku kropli fenoloftaleiny umieszczono 2,96 g próbki pewnego nasyconego alifatycznego kwasu jednokarboksylowego. Zawartość naczynia wymieszano i uzupełniono wodą destylowaną do objętości 150 cm3, a następnie zmiareczkowano wodnym roztworem wodorotlenku sodu o stężeniu 0,4 mol∙dm-3. Punkt równoważnikowy osiągnięto w momencie wykorzystania 100 cm3 roztworu wodorotlenku.
Wykonaj niezbędne obliczenia i ustal wzór sumaryczny kwasu, którego wodny roztwór poddano miareczkowaniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone