Fibrynogen - białko wchodzące w skład osocza krwi
Fibrynogen jest jednym z białek wchodzących w skład osocza krwi.
Spośród odpowiedzi A–D wybierz i zaznacz właściwy opis roli tego białka w organizmie.
A. Reguluje ilość wody we krwi.
B. Transportuje gazy oddechowe.
C. Uczestniczy w odporności organizmu.
D. Bierze udział w procesie krzepnięcia krwi.
Rozszyfrowanie symbolu pierwiastka chemicznego oraz określenie jego położenia w układzie okresowym. Zadanie 1.1. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
• elektrony rozmieszczone są na czterech powłokach elektronowych
• na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
Uzupełnij poniższą tabelę – wpisz symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.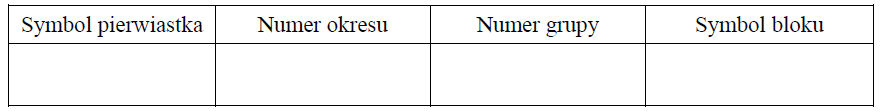
Uzupełnienie schematu klatkowego konfiguracji elektronowej rozszyfrowanego pierwiastka chemicznego. Zadanie 1.2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
• elektrony rozmieszczone są na czterech powłokach elektronowych
• na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
Uzupełnij poniższy zapis (stosując schematy klatkowe), tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym pierwiastka X. W zapisie tym uwzględnij numery powłok i symbole podpowłok. Podkreśl ten fragment konfiguracji, który nie występuje w konfiguracji elektronowej jonu X2+ (stan podstawowy).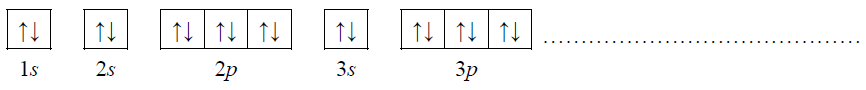
Ocena poprawności zdań dotyczących wapnia oraz potasu. Zadanie 2. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W poniższej tabeli zestawiono wybrane właściwości fizyczne potasu i wapnia.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. Podczas reakcji wapnia i potasu z wodą te metale pływają po powierzchni wody, ponieważ gęstość każdego z nich jest mniejsza od gęstości wody. 2. Atomy wapnia i potasu, oddając elektrony walencyjne, przechodzą w dodatnio naładowane jony o konfiguracji elektronowej tego samego gazu szlachetnego. 3. Atomy wapnia są mniejsze od atomów potasu; dwudodatnie jony wapnia są mniejsze od jednododatnich jonów potasu.
Wybór poprawnych określeń dotyczących wapnia oraz potasu. Zadanie 3. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W poniższej tabeli zestawiono wybrane właściwości fizyczne potasu i wapnia.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Na podstawie informacji i układu okresowego pierwiastków uzupełnij poniższe zdania. Wybierz i zaznacz jedno właściwe określenie spośród podanych w każdym nawiasie. 1. Węzły sieci krystalicznych wapnia, jak i potasu obsadzone są (dodatnio / ujemnie) naładowanymi jonami zwanymi rdzeniami atomowymi. Pomiędzy rdzeniami atomowymi obecne są słabo związane elektrony walencyjne, które mogą wędrować swobodnie przez kryształ metalu. Dlatego zarówno wapń, jak i potas odznaczają się (dużą / małą) przewodnością elektryczną. 2. Temperatura topnienia wapnia jest (niższa / wyższa) niż temperatura topnienia potasu, co wynika między innymi (z silniejszego / ze słabszego) wiązania metalicznego, utworzonego z udziałem (mniejszej / większej) liczby elektronów walencyjnych.
Obliczanie składu mieszaniny poreakcyjnej uzyskanej w wyniku spalania amoniaku. Zadanie 4. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Do reaktora wprowadzono 1,0 mol amoniaku i 1,6 mola tlenu, a następnie przeprowadzono – w odpowiednich warunkach – reakcję zilustrowaną poniższym równaniem.
![]()
Wykonaj obliczenia i podaj skład mieszaniny poreakcyjnej wyrażony w molach. Załóż, że opisana przemiana przebiegła z wydajnością równą 100%.
Określenie, czy układ oddaje energię do otoczenia, czy ją przyjmuje. Zadanie 5. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.
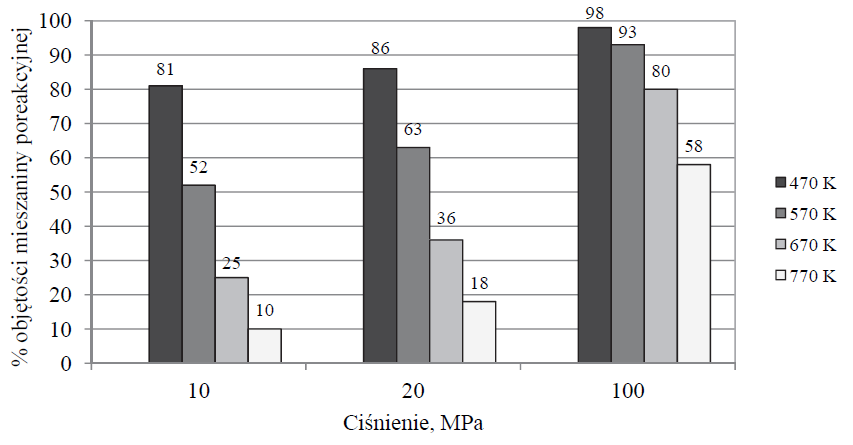
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w czasie opisanej reakcji układ oddaje energię do otoczenia, czy przyjmuje ją od otoczenia. Odpowiedź uzasadnij.
Określenie, czy liczba moli substratów jest większa, równa, bądź mniejsza od liczby moli produktów. Zadanie 6. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie analizy diagramu określ, czy w równaniu stechiometrycznym opisanej reakcji łączna liczba moli substratów jest mniejsza, czy – większa od liczby moli produktu, czy też – równa liczbie moli produktu. Odpowiedź uzasadnij.
Wybór właściwego równania reakcji chemicznej na podstawie diagramu opisującego zawartość reagenta w zależności od ciśnienia i temperatury. Zadanie 7. Arkusz CKE chemia maj 2016 rozszerzony (1 punkt)
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Spośród reakcji, których równania przedstawiono poniżej, wybierz tę, do której mógłby odnosić się przedstawiony diagram. Zaznacz wybraną odpowiedź. 1. H2 (g) + Cl2 (g) → 2HCl (g) ΔH < 0 2. H2 (g) + I2 (g) → 2HI (g) ΔH > 0 3. N2 (g) + 3H2 (g) → 2NH3 (g) ΔH < 0 4. 2Cl2 (g) + O2 (g) → 2Cl2O (g) ΔH > 0
Obliczanie stopnia dysocjacji amoniaku. Zadanie 8. Arkusz CKE chemia maj 2016 rozszerzony (2 punkty)
Amoniak bardzo dobrze rozpuszcza się wodzie, a w powstałym roztworze zachodzi reakcja opisana równaniem:
NH3 + H2O ⇄ NH4+ + OH–
Oblicz, jaki procent wszystkich wprowadzonych do wody cząsteczek amoniaku ulega tej reakcji w wodnym roztworze amoniaku o stężeniu 0,1 mol·dm–3 w temperaturze 298 K. Przyjmij, że (w opisanych warunkach) reakcji ulega mniej niż 5% wprowadzonych do wody cząsteczek amoniaku.